2e volet de notre série « Intelligence artificielle et diabète »
En analysant les données biocliniques associées au diabète, l’intelligence artificielle (IA) a la capacité de classer les patients diabétiques, autrement dit d’obtenir une stratification plus fine (sous-phénotypage) que la répartition classique en diabète de type 1 (DT1) et diabète de type 2 (DT2).
Publiée en 2018 dans la revue The Lancet Diabetes and Endocrinology, une étude suédoise a utilisé les données d’une cohorte de 8 980 patients récemment diagnostiqués diabétiques. Une IA a analysé les variables suivantes : anticorps anti-GAD (glutamate acide décarboxylase), âge au moment du diagnostic, l’IMC, l’hémoglobine glyquée (HbA1c, reflet de la glycémie), l’indice HOMA, qui permet de mettre en évidence une résistance à l’insuline sur la base de la glycémie et de l’insulinémie à jeun.
L’analyse obtenue a été confrontée aux données prospectives issues de dossiers de patients concernant la survenue de complications et les traitements prescrits. Un algorithme a permis de regrouper des individus ayant des caractéristiques similaires (clusters), après quoi l’analyse de ces clusters par l’apprentissage automatique a identifié cinq groupes distincts de diabète : le diabète auto-immun sévère (SAID), le diabète insulinodéficient sévère (SIDD), le diabète insulinorésistant sévère (SIRD), le diabète léger lié à l’obésité (MORD) et le diabète léger lié à l’âge (MARD). Cette nouvelle classification du diabète pourrait permettre d’adapter de manière plus précise les traitements et d’identifier les individus à risque accru de complications au moment du diagnostic.
Mieux catégoriser le profil glycémique des patients vivant avec un DT1
De la même façon, une étude menée par des médecins du Luxembourg Institute of Health a mis en évidence l’existence de multiples profils glycémiques dans le DT1. Publiée en mai 2024 dans la revue Diabetologia, elle a porté sur 618 participants atteints de diabète de type 1 (DT1). En utilisant des méthodes d’intelligence artificielle (IA) sur les données de la cohorte française SFDT1 (Suivi en France de personnes vivant avec un DT1), ces chercheurs ont identifié sept profils glycémiques (phénotypes) distincts dans le DT1.
L’analyse a utilisé, en plus de l’âge, six paramètres de suivi du diabète : l’HbA1c (hémoglobine glyquée), le temps dans la cible (TIR, pourcentage de temps passé entre 0,7 g/L et 1,80 g/L), le temps en hypoglycémie (TBR, pourcentage de temps passé sous 0,7 g/L), le coefficient de variation (CV, qui renseigne sur la variabilité glycémique), le Gold score et le GRI (glycemic risk index). Le Gold score repose sur une seule question : « Savez-vous quand débutent vos hypoglycémies ? ». Le GRI est un nouveau paramètre composite, calculé à partir des critères classiques de mesure du glucose en continu, et qui évalue le risque d’exposition à l’hypo- et à l’hyperglycémie.
En identifiant jusqu’à 7 profils glycémiques dans le diabète de type 1, cette étude indique que les stratégies basées sur des valeurs glycémiques isolées ne permettent sans doute pas de saisir toute la complexité des phénotypes glycémiques dans la vie réelle. En effet, ce modèle d’IA a permis d’obtenir plus de précision que la traditionnelle classification en sous-groupes de patients atteints de DT1. Parvenir à ce niveau de précision pourrait contribuer à améliorer le suivi des personnes atteintes de DT1 et à mieux personnaliser leur traitement.
Déterminer des sous-phénotypes métaboliques chez des individus à risque de DT2
Le diabète de type 2 (DT2) et son précurseur, le prédiabète, sont actuellement définis en fonction du taux de glycémie plutôt que sur les mécanismes physiopathologiques sous-jacents. Des chercheurs américains ont récemment utilisé l’intelligence artificielle dans le but de classer les individus en fonction de leur profil métabolique associé à un risque de développer un diabète de type 2 plutôt qu’en tenant compte des valeurs de la glycémie.
En effet, selon l’anomalie métabolique observée, la stratégie de prévention ou de traitement pourrait être différente. En d’autres termes, le sous-phénotype métabolique pourrait non seulement influer sur le risque de développer un DT2, mais également conditionner l’efficacité de la prise en charge thérapeutique ou celle des recommandations hygiéno-diététiques. Pouvoir catégoriser les individus en fonction de l’altération métabolique prédominante permettrait donc de mettre en place une médecine de précision à un stade précoce en vue de prévenir et/ou traiter un DT2.
On sait notamment que selon l’âge et l’obésité, certains patients répondent mieux au traitement par la metformine (médicament antidiabétique) qu’ils ne tirent de bénéfice des mesures hygiéno-diététiques. De même, selon le sexe et l’IMC (indice de masse corporelle), certains patients répondent mieux ou moins bien à certaines classes de médicaments antidiabétiques (thiazolidinediones, sulfamides hypoglycémiants). La variabilité des réponses selon les individus pourrait donc refléter des différences dans la physiologie métabolique sous-jacente, étant donné que les interventions pharmacologiques et celles liées au mode vie ciblent différents mécanismes physiologiques impliqués dans l’hyperglycémie.
Publiée en décembre 2024 dans la revue Nature Biomedical Engineering, une étude de chercheurs de l’université de Stanford (Californie) montre que l’IA basée sur le machine learning, et utilisant la surveillance du glucose en continu, permet de prédire différents profils (sous-phénotypes) métaboliques pouvant participer à la survenue d’un diabète de type 2. Ces sous-phénotypes métaboliques peuvent être prédits à partir de la forme de la courbe des valeurs de la glycémie durant une hyperglycémie provoquée par voie orale (HGPO) réalisée à domicile. Cet examen consiste à évaluer la tolérance de l’individu au glucose après administration d’une charge de 75 g de glucose par voie orale chez des personnes porteuses d’un système de mesure du glucose en continu. Celui-ci permet de suivre les taux de glucose grâce à un petit capteur (Dexcom G6) placé sous la peau de l’abdomen ou du bras. Ce dispositif mesure la concentration du glucose dans le liquide interstitiel qui se trouve entre les cellules.
La courbe des concentrations de glucose a été établie à partir de 16 mesures effectuées toutes les 5 à 15 minutes d’intervalle lors de deux HGPO. Celles-ci ont été réalisées à domicile, dans des conditions standardisées, sur une période de dix jours et chacune pendant 180 minutes (et non deux heures comme habituellement).
Trois cohortes ont été incluses dans cette étude : une cohorte de 32 individus pour l’entraînement du modèle de machine learning, une deuxième composée de 24 personnes pour la validation du modèle et une troisième de 29 personnes pour évaluer la faisabilité d’un sous-phénotypage métabolique à partir des mesures du glucose en continu lors de deux HGPO réalisées à domicile.
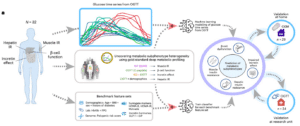
Quatre paramètres métaboliques, connus pour contribuer à la dérégulation du glucose et au diabète de type 2 (DT2), ont été évalués. Les chercheurs ont tout d’abord mesuré l’insulinorésistance musculaire. L’insulinorésistance est définie par la nécessité d’un excès d’insuline pour obtenir une réponse normale à cette hormone. Elle se traduit par une moindre efficacité de l’insuline sur un de ses tissus cibles, dont le muscle squelettique. L’apparition d’une insulinorésistance musculaire joue un rôle majeur dans le DT2. Ce paramètre varie pour un même degré de glycémie. Ainsi, des patients ayant un prédiabète, avec une hémoglobine glyquée (HbA1c) élevée, peuvent être sensibles à l’insuline, alors que d’autres, ayant une glycémie normale, peuvent être particulièrement résistants à l’insuline. L’insulinorésistance n’est pas donc synonyme d’une élévation de la glycémie.
Les chercheurs ont également évalué la sécrétion d’insuline, en mesurant la concentration de peptide-C (qui renseigne sur la production endogène d’insuline). Ce paramètre a été ajusté en fonction de la résistance à l’insuline pour générer un indice permettant d’évaluer la fonction de la cellule bêta. Certains participants avaient des cellules bêta très dysfonctionnelles, tandis que d’autres avaient des cellules bêta saines. Parmi les patients ayant un prédiabète, la fonction de cette cellule sécrétrice d’insuline varie donc grandement.
Le troisième paramètre évalué est ce que l’on appelle l’effet incrétine qui se manifeste par le fait que la sécrétion d’insuline induite par l’ingestion d’une charge orale de glucose est supérieure à celle provoquée par l’administration de glucose par voie intraveineuse. Les incrétines, notamment le glucagon-like peptide-1 (GLP-1) et le glucose-dependent insulinotropic polypeptide (GIP), sont des hormones libérées par l’intestin tout au long de la journée et leurs taux augmentent en réponse à un repas. On estime que jusqu’à 70 % de l’insuline sécrétée après un repas résulte de l’effet incrétine. Une altération de l’axe incrétine contribue de manière significative au défaut de sécrétion de l’insuline dans le DT2. Là encore, il s’avère que l’effet incrétine était extrêmement hétérogène entre les participants et n’était pas corrélé à la fonction de la cellule bêta, ni à l’insulinorésistance.
Le quatrième et dernier paramètre analysé a été la résistance hépatique à l’insuline. Il a été calculé par une équation mathématique tenant compte de la concentration sanguine d’insuline, du taux plasmatique du HDL-cholestérol, de l’IMC, de l’âge, du sexe et du pourcentage de masse grasse. La résistance hépatique à l’insuline conduit à une augmentation de la production de glucose par le foie, qui est corrélée à l’hyperglycémie à jeun.
Pour chacun des participants, l’équipe dirigée à l’université de Stanford par Tracey McLaughlin et Michael Snyder a déterminé quel mécanisme était le plus affecté et a ainsi classé les individus selon un sous-phénotype métabolique dominant unique ou de deux phénotypes codominants. Chez certains individus, l’effet incrétine était le paramètre le plus altéré, pour d’autres, l’atteinte prédominante concernait le fonctionnement de la cellule bêta. Le dysfonctionnement de cette dernière était significativement corrélé à l’insulinorésistance musculaire.
Les tests métaboliques standards réalisés chez 32 individus présentant une dérégulation du glucose d’apparition précoce ont révélé des sous-phénotypes dominants ou codominants. Une insulinorésistance musculaire ou résistance hépatique à l’insuline a ainsi été identifiée chez 34 % des individus, tandis qu’un dysfonctionnement de la cellule bêta ou une altération de l’effet incrétine était présent chez 40 % d’entre eux. Par ailleurs, une insulinorésistance musculaire et une résistance hépatique à l’insuline sont fréquemment associées.
Il apparaît donc que les individus ayant un taux de glucose allant de la normoglycémie au prédiabète présentent une hétérogénéité dans quatre processus physiopathologiques distincts : l’insulinorésistance musculaire, le dysfonctionnement de la cellule bêta, l’effet incrétine et la résistance hépatique à l’insuline. De plus, ces sous-phénotypes métaboliques ne sont pas nécessairement corrélés aux paramètres glycémiques classiques, tels que l’hémoglobine glyquée (HbA1c).
Analyse par machine learning de la courbe générée par un système de mesure du glucose en continu
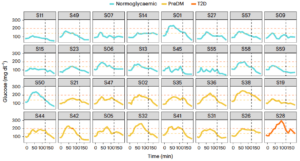
Les modèles de machine learning entraînés avec les données issues des courbes de concentrations du glucose obtenues à partir des HGPO réalisées chez ces 32 individus ont prédit avec une grande précision* les sous-phénotypes correspondant à une insulinorésistance musculaire, un dysfonctionnement de la cellule bêta, une anomalie de l’effet incrétine.
Ces modèles d’IA ont ensuite été utilisés dans l’espoir d’identifier avec la même précision les sous-phénotypes métaboliques à partir de l’analyse des données de mesure du glucose en continu obtenues chez 29 participants ayant passé deux HGPO à domicile (5 appartenant à la cohorte initiale et 24 à la cohorte de validation). Il s’avère que le modèle de machine learning a permis de prédire avec une performance satisfaisante les sous-phénotypes définis par une insulinorésistance musculaire et/ou un dysfonctionnement de la cellule bêta.
Cette étude montre qu’il est donc possible, grâce à une IA, de déterminer des sous-phénotypes métaboliques chez des individus présentant un début de dérégulation du glucose. Ceci a été obtenu par un modèle de machine learning qui a analysé des jeux de données dynamiques issues de la courbe des concentrations de glucose obtenues lors de deux hyperglycémies provoquées par voie orale réalisées à domicile dans des conditions standardisées.
Ce système d’IA ne dépend donc pas de résultats obtenus par des examens sophistiqués, laborieux, coûteux, nécessitant des perfusions intraveineuses. Elle s’avère par ailleurs capable d’identifier des sous-phénotypes métaboliques avec une efficacité supérieure à ce que permettent les mesures, cliniques et biologiques, réalisées dans des unités de recherche.
Seuls 9 % des participants n’ont pu être classés comme ayant un sous-phénotype dominant ou codominant. Cette étude montre donc qu’il est possible grâce à l’IA de classer la quasi-totalité des individus normoglycémiques ou prédiabétiques en fonction d’un sous-phénotypage métabolique.
« L’identification de sous-phénotypes métaboliques distincts en analysant par machine learning les caractéristiques des données dynamiques des concentrations de glucose durant les HGPO, notamment celles réalisées à domicile avec un système de mesure du glucose en continu, peut permettre de repérer précocement les individus à risque qui peuvent bénéficier d’un traitement pharmacologique ciblé et des mesures hygiéno-diététiques afin de prévenir le DT2 », déclarent les auteurs de l’étude.
Reste à confirmer ces résultats par une étude portant de plus grands effectifs et déterminer si cette approche peut être utilisée chez des individus diabétiques de type 2 ayant une hyperglycémie plus prononcée.
Selon les chercheurs californiens, ces résultats pourraient à terme ouvrir la voie à une médecine de précision à un stade précoce de la dérégulation glycémique dans la mesure où la prise en charge pourrait être différente selon que la personne présente tel ou tel sous-phénotype métabolique dominant.
Ainsi, les patients présentant un sous-phénotype caractérisé par une insulinorésistance pourraient bénéficier d’interventions et de thérapies visant à améliorer la résistance à l’insuline, telles que les mesures diététiques, l’activité physique, les nouveaux médicaments anti-obésité (agonistes du GLP-1 ou co-agonistes des récepteurs du GIP et du GLP-1), la metformine, thiazolidinediones. Les patients présentant un sous-phénotype où domine le dysfonctionnement de la cellule bêta ou l’altération de l’effet incrétine pourraient, eux, bénéficier de traitements visant à augmenter ou remplacer la sécrétion d’insuline, comme les sulfamides hypoglycémiants, les inhibiteurs de la dipeptidylpeptidase-4 (DPP-4), les agonistes du GLP-1, les co-agonistes des récepteurs du GIP et du GLP-1 ou l’insuline.
Dans l’avenir, si un processus physiopathologique dominant pouvait être identifié chez tout individu présentant une dérégulation du glucose à un stade précoce, il serait possible d’administrer un traitement ciblé, dans un but préventif ou thérapeutique, en utilisant une telle approche de médecine de précision guidée par l’IA.
L’utilisation de modèles de machine-learning appliqués à l’identification, à l’hôpital ou à domicile, de sous-phénotypes métaboliques particuliers chez des patients à risque de développer un DT2, ou présentant un DT2 précoce, ne fait peut-être que commencer.
À suivre.
Marc Gozlan (Suivez-moi sur X, Facebook, LinkedIn, Mastodon, Bluesky)
Lire le 1er volet de la série “Intelligence artificielle et diabète”
* Une aire sous la courbe (AUC, area under the curve) de 100 % indique que la performance du modèle est parfaite. L’AUC a été de 95 % pour l’insulinorésistance musculaire, de 89 % pour le dysfonctionnement de la cellule bêta et de 88 % pour la perturbation de l’effet incrétine.