2e PARTIE :
Les autres acteurs impliqués dans les liens entre obésité et cancer
Le dérèglement des lymphocytes T associé à l’obésité n’explique cependant pas à lui seul tous les effets de l’obésité sur l’immunité anti-tumorale et l’immunothérapie. D’autres acteurs semblent impliqués. En premier lieu : le tissu adipeux.
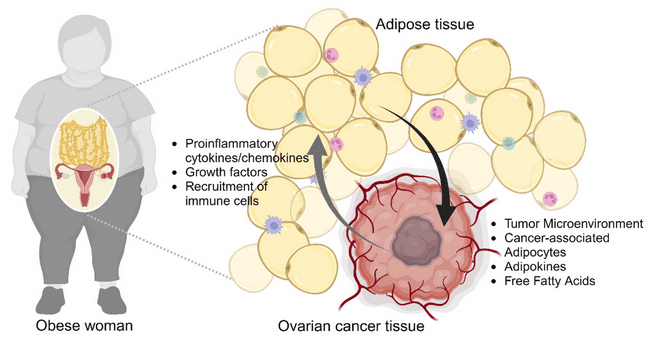
Tissu adipeux
Dans l’obésité, le tissu graisseux est dérégulé. Il est infiltré par des cellules immunitaires, telles que des macrophages et des lymphocytes T CD8+ qui provoquent une inflammation tissulaire en sécrétant de nombreuses cytokines pro-inflammatoires (TNF, interféron-gamma, interleukine-17).
De fait, une inflammation chronique à bas bruit est une caractéristique commune aux cancers associés à l’obésité. Dans un tel contexte, les adipocytes (cellules graisseuses) sécrètent des taux élevés d’interleukine-6, de TNF, d’adipokines (cytokines produites par le tissu adipeux et jouant un rôle dans la production et l’utilisation d’énergie) et de leptine. L’ensemble de ces molécules proinflammatoires favorise le développement de la cancérogenèse et de la prolifération tumorale.
À cela se surajoutent d’autres facteurs métaboliques, notamment des taux élevés d’insuline et une altération du métabolisme du tryptophane, un acide aminé essentiel apporté par l’alimentation. Les altérations du métabolisme du tryptophane apparaissent très tôt dans la carcinogenèse du côlon comme un mécanisme permettant à la tumeur d’échapper à la surveillance immunitaire et à former des métastases. Certains métabolites du tryptophane induits par le microbiote sont impliqués dans le développement du cancer colorectal.
Lymphocytes T CD8+
Les lymphocytes T CD8+, qui assurent la surveillance immunitaire des cancers et infiltrent la tumeur, ne sont pas les seuls acteurs de la réponse immune contre les cellules tumorales. Il faut aussi compter avec les cellules NK (Natural killer), les cellules dendritiques et les macrophages.
Cellules NK
Les cellules NK forment une composante importante de l’immunité innée, dédiée à la défense de l’hôte contre les virus et également impliquée dans l’immunosurveillance des tumeurs. Elles sont distribuées dans tout l’organisme.
Les lymphocytes NK (Natural killer) jouent un rôle important et infiltrent, eux aussi, la tumeur.
Cellules dendritiques
Bien que les lymphocytes T soient considérés comme les principaux acteurs de la réponse immunitaire anti-tumorale, ils interagissant avec d’autres cellules immunitaires, en particulier avec les cellules dendritiques qui sont la première ligne pour détecter les antigènes étrangers et toutes sortes d’agressions. Les cellules dendritiques, ainsi appelées en raison de leurs nombreuses extensions membranaires, capturent et présentent les antigènes (infectieux, tumoraux, provenant de substances étrangères) aux lymphocytes T. Cette rencontre entre les lymphocytes T et les cellules dendritiques induit la différenciation des lymphocytes T en cellules capables de tuer leurs cibles. Les lymphocytes T dits « naïfs » deviennent alors des cellules « effectrices ». En activant les lymphocytes T CD8+, les cellules dendritiques participent donc à la réponse immunitaire adaptative qui constitue la seconde ligne de défense de l’organisme.
Des taux élevés de lipides circulants sont une des caractéristiques de l’obésité. Des études ont montré que les tumeurs utilisent les lipides pour supprimer l’activation des lymphocytes T CD8+ en limitant la présentation des antigènes tumoraux par les cellules dendritiques. Cela dit, en dehors du rôle des lipides, on sait encore peu de choses sur les effets de l’obésité sur l’activation des lymphocytes T CD8+ par les cellules dendritiques.
Macrophages
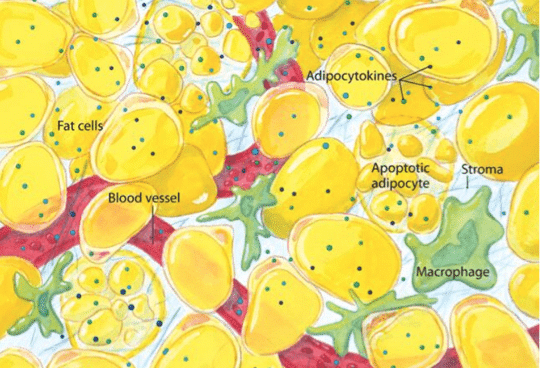
Les lymphocytes T CD8+ ne sont pas les seules cellules immunitaires infiltrant la tumeur. Les macrophages font de même et peuvent même représenter le principal contingent de cellules immunitaires résidant dans la masse tumorale.
Or les macrophages peuvent soit activer la réponse immunitaire vis-à-vis de la tumeur, soit avoir un effet inverse, immunosuppresseur. En effet, en plus de participer au sein de la tumeur à une inflammation chronique, les macrophages exercent une activité immunosuppressive, qui favorise la croissance tumorale et la formation de métastases via la sécrétion de cytokines et de molécules favorisant la prolifération de nouveaux vaisseaux (facteurs proangiogéniques).
Disponibilité en nutriments
Enfin, la disponibilité en nutriments et leur captation par la masse tumorale jouent un rôle crucial dans l’interaction entre cellules immunitaires et cellules tumorales.
Dans un contexte d’obésité, plusieurs études ont montré l’existence au sein du microenvironnement tumoral d’une compétition en nutriments entre cellules immunitaires et cellules tumorales, en particulier pour le glucose.
Chez des souris obèses, alors qu’une captation accrue par les cellules tumorales en lipides et l’oxydation des acides gras a été observée, il a été montré que les lymphocytes T CD8+ incorporent moins de lipides.
Chez la souris, il s’avère que l’obésité altère donc la composition en nutriments ainsi que le métabolisme des cellules tumorales et immunitaires au sein du microenvironnement tumoral. Reste à savoir ce qu’il en est lors du développement du cancer chez l’être humain.
Vaisseaux lymphatiques associés à la tumeur
Un dernier acteur est récemment venu s’ajouter à cette liste : le système lymphatique qui véhicule la lymphe, mais également les antigènes, les globules blancs et les cellules tumorales jusqu’aux ganglions lymphatiques.
Les vaisseaux lymphatiques semblent jouer un rôle important, via leur fonction de transport, dans l’immunité tissulaire locale. Ceux entourant et pénétrant la tumeur semblent avoir, selon les cas, un impact positif ou négatif sur la surveillance immunitaire anti-tumorale. Les vaisseaux lymphatiques pourraient en outre représenter un acteur majeur de la réponse à l’immunothérapie des cancers.
Microbiote intestinal
Une autre composante intervient également dans la carcinogenèse dans un contexte d’obésité : le microbiote intestinal. Il a été suggéré qu’un déséquilibre du microbiote peut générer des métabolites cancérigènes, provoquer une dérégulation métabolique et favoriser une inflammation à bas bruit, autant de facteurs pouvant favoriser le développement d’une tumeur.
Les études publiées soutiennent l’hypothèse selon laquelle les bactéries et/ou des métabolites intestinaux, dans un contexte d’une alimentation trop riche en graisses, promeuvent la tumorigenèse.
Par ailleurs, la composition du microbiote a été étudiée dans le contexte d’une immunothérapie anti-tumorale. Il a été montré que chez les patients atteints de mélanome, le microbiote pourrait servir de marqueur de l’effet positif du traitement.
Des études ont montré que l’obésité associée à une alimentation riche en graisses est associée au développement du cancer du sein chez les femmes post-ménopausées. On estime ainsi que 30 % des cancers du sein féminins seraient évitables via un contrôle du poids.
Une étude chinoise, publiée le 6 mai 2024 dans les Comptes rendus de l’Académie américaine des Sciences (PNAS), apporte un éclairage très intéressant sur l’impact du microbiote intestinal associé à une alimentation riche en graisses sur la progression du cancer. Elle montre qu’un tel régime est corrélé à une progression rapide et à un pronostic défavorable dans des modèles animaux de cancer du sein et de mélanome.
Pour évaluer le rôle du microbiote associé à l’obésité dans la progression du cancer mammaire, les chercheurs de l’université Sun-Yat-sen (province du Guangdong) ont utilisé des souris transgéniques, modèles murins de cancer du sein.
- Le déséquilibre du microbiote intestinal favorise la progression tumorale chez la souris
Leurs observations montrent qu’un régime alimentaire riche en graisses, de même que la transplantation du microbiote fécal provenant de souris recevant une alimentation riche en graisses, stimule la progression du cancer mammaire chez ces souris, en comparaison avec celles ayant une alimentation normale ou transplantées avec le microbiote de souris recevant un régime alimentaire normal. Lorsque des souris recevant un régime riche en graisses (high-fat diet, HFD) ont reçu un cocktail d’antibiotiques destiné à éliminer le microbiote associé à ce type d’alimentation, cette antibiothérapie a freiné la croissance tumorale.
Des résultats comparables ont été obtenus lorsque les chercheurs ont évalué la progression de tumeurs mammaires greffées à des souris. La croissance tumorale a été accélérée chez celles qui recevaient un régime riche en graisses ou celles qui avaient été transplantées avec le microbiote de souris recevant un régime hyperlipidique (HFD). Là encore, leur croissance tumorale rapide était contrecarrée par le traitement antibiotique.
L’ensemble de ces résultats montre donc qu’un régime riche en graisses favorise la progression tumorale par l’intermédiaire du déséquilibre (dysbiose) du microbiote intestinal. Afin de déterminer quelles familles de bactéries intestinales sont impliquées dans l’accélération de la croissance tumorale, les chercheurs ont analysé les matières fécales des souris. Ils ont alors observé l’abondance des bactéries intestinales Desulfovibrio chez les souris recevant un régime riche en graisses, les mêmes que l’on retrouve en grand nombre chez des patientes obèses ou en surpoids atteintes de cancer du sein.
- Le microbiote associé à un régime hyperlipidique augmente la différenciation de certaines cellules de la moelle osseuse
Les chercheurs ont ensuite analysé les cellules immunitaires présentes dans le tissu tumoral. Ils ont observé que un nombre élevé de cellules dénommées cellules myéloïdes suppressives (MDSC pour myeloid-derived suppressor cells). Ces cellules immatures, issues de la moelle osseuse, migrent au sein de la tumeur. Elles sont capables d’inhiber les fonctions des lymphocytes T. En s’accumulant au cours de la croissance tumorale, elles contribuent au développement du cancer.
Chez les souris recevant un régime riche en graisses et chez celles ayant été transplantées avec le microbiote de souris recevant un tel régime, les chercheurs ont observé une augmentation d’une sous-catégorie de ces cellules myéloïdes suppressives, appelées PMN-MDSC (polymorphonuclear myeloid-derived suppressor cells), au sein de la tumeur et dans le sang. Le nombre de ces cellules PMN-MDSC infiltrant la tumeur et circulantes était en revanche réduit lorsque les souris étaient traitées par antibiotiques.
Ces résultats soulignent ainsi le rôle crucial joué par le microbiote, en l’occurrence la dysbiose intestinale, dans l’augmentation du nombre de cellules MDSC chez les souris recevant un régime hyperlipidique.
De même, des taux élevés de cellules myéloïdes suppressives infiltrant la tumeur, en particulier des PMN-MDSC, ont été observés chez des souris ayant été greffées avec des cellules tumorales de mélanome, par rapport à ce qui est observé chez des souris recevant un régime alimentaire normal ou celles nourries avec un régime hyperlipidique (HFD) et traitées par antibiotiques.
En outre, lorsque les chercheurs ont administré chez des souris recevant un régime HFD, ou ayant reçu le microbiote de souris nourries avec ce régime, des anticorps pour éliminer les cellules MDSC, ils ont observé un ralentissement de la croissance tumorale. Ces résultats montrent donc que l’altération du microbiote intestinal induit par un régime hyperlipidique favorise la progression de la tumeur via les cellules myéloïdes suppressives (MDSC).
- L’enrichissement du microbiote intestinal en Desulfovibrio induit la production de leucine
Les chercheurs ont ensuite montré que les bactéries du microbiote intestinal induit préférentiellement par un régime hyperlipidique, en particulier les Desulfovibrio, produisent de la leucine, un acide aminé. Il s’avère qu’en comparaison avec les souris nourries normalement, les taux de leucine étaient significativement plus élevés dans les matières fécales et dans le sang des souris recevant un régime hyperlipidique et celles ayant reçu le microbiote de souris nourries avec ce régime HFD. Ces concentrations en leucine étaient significativement et positivement corrélées à l’abondance en bactéries Desulfovibrio. L’administration d’antibiotiques a entraîné une réduction des taux de leucine dans leurs matières fécales.
- La leucine déclenche la différenciation de cellules myéloïdes suppressives
Surtout, les chercheurs chinois ont montré que la leucine déclenche de façon très puissante la production de cellules PMN-MDSC par la moelle osseuse. En d’autres termes, la leucine induit la différenciation des cellules myéloïdes suppressives. D’ailleurs, l’administration de quantités importantes de leucine à des souris favorise significativement la progression d’une tumeur mammaire. Un gavage en leucine a également induit une augmentation du nombre de cellules PMN-MDSC dans la tumeur et dans le sang des rongeurs. Des résultats similaires ont été obtenus chez des souris porteuses d’un mélanome. Là encore, l’administration d’anticorps neutralisant les cellules MDSC a entravé la progression de la tumeur.
Ces résultats indiquent qu’un régime hyperlipidique induit la production de cellules myéloïdes suppressives (MDSC) et la progression tumorale du fait d’un approvisionnement accru en leucine à partir d’un important contingent de bactéries de la flore intestinale associées à un régime hyperlipidique.
Les expériences des chercheurs révèlent que la bactérie Desulfovibrio desulfuricans (capable de réduire les sulfates en sulfures, puis en hydrogène sulfuré) joue un rôle crucial dans le développement tumoral. Le gavage de souris dépourvues de bactéries (sans germe, germ-free) avec Desulfovibrio desulfuricans a par ailleurs entraîné des taux élevés de leucine dans leurs matières fécales.
Ces résultats montrent que Desulfovibrio, dont le nombre augmente grandement chez les souris recevant un régime hyperlipidique, produisent de la leucine qui va stimuler la production de cellules PMN-MDSC qui, à leur tour, vont favoriser la progression du cancer. Les chercheurs ont également déterminé le mécanisme biochimique par lequel la leucine induit la production de ces cellules myéloïdes suppressives MDSC qui s’opposent à la prolifération et l’action antitumorale des lymphocytes T. La leucine agit sur la voie de signalisation mTORC1, qui joue un rôle central dans l’activation d’une cascade de réactions biochimiques sur de nombreuses protéines intracellulaires.
- Relation entre le taux de leucine, le microbiote associé à un régime hyperlipidique et la progression tumorale dans le cancer du sein
Les chercheurs chinois ont enfin voulu confirmer, chez la femme, la corrélation observée chez souris entre le microbiote associé à un régime riche en graisses et la progression du cancer mammaire. Le sérum de 181 femmes atteintes de cancer du sein a été analysé, dont 58 qui avaient un indice de masse corporelle (IMC) supérieur à 24 et 105 autres dont l’IMC était égal ou inférieur à 24. En outre, 18 femmes porteuses d’une tumeur bénigne du sein ont été incluses dans l’étude.
Il ressort de l’analyse que des taux faibles de leucine dans le sérum de ces femmes sont corrélés à une plus longue survie sans progression, ainsi qu’à un plus faible taux de récidive locale. Par ailleurs, les taux de leucine ont été déterminés dans les matières fécales de 61 patientes atteintes d’un cancer du sein. Ces taux étaient positivement corrélés avec la présence de la bactérie Desulfovibrio, dont le nombre était significativement augmenté chez les patientes en surpoids ou obèses. Là encore, ces résultats indiquent que le taux de leucine est dépendant du microbiote intestinal associé à l’obésité.
Il a été montré que chez les femmes atteintes de cancer du sein le nombre de cellules MDSC dans le tissu tumoral est significativement plus élevé chez celles en surpoids ou obèses que chez celles avec un IMC inférieur à 24. Ce taux en cellules MDSC au sein de la tumeur est positivement corrélé aux taux de leucine dans le sang.
Enfin, des souris porteuses d’un cancer mammaire ont reçu une transplantation de microbiote fécal provenant de sujets de poids normal et de personnes obèses afin d’évaluer l’impact du microbiote intestinal sur la progression tumorale chez ces rongeurs. Comme on pouvait s’y attendre, les bactéries Desulfovibrio étaient plus nombreuses dans l’intestin des souris ayant reçu une transplantation de microbiote fécal de sujets obèses, par rapport à celles recevant un microbiote fécal de donneurs au poids normal. En outre, seule la transplantation de microbiote fécal de sujets obèses favorisait la croissance tumorale de la tumeur mammaire chez ces rongeurs.
Ces résultats montrent donc que la leucine produite par le microbiote intestinal associé à un régime riche en graisses (HFD) active la voie de signalisation mTORC1 dans la moelle osseuse, ce qui déclenche la production de cellules myéloïdes suppressives PMN-MDSC, qui elle-même favorise la progression du cancer du sein.
- Progression tumorale via un axe « intestin-moelle osseuse-tumeur »
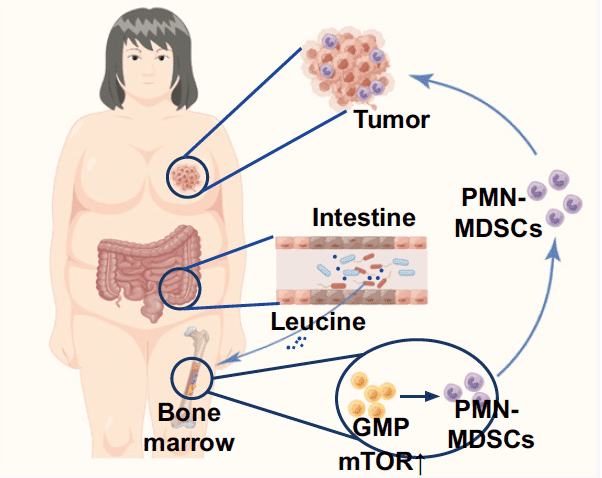
Cette étude monte donc qu’existe un axe intestin-moelle osseuse-tumeur impliqué dans la progression du cancer dans le cadre d’une alimentation riche en graisses et en situation d’obésité. Selon les chercheurs chinois, ceci ouvre la voie à de possibles stratégies thérapeutiques anti-tumorales qui auraient cet axe pour cible.
En conclusion
On le voit, l’obésité est un facteur de risque majeur de cancer et le système immunitaire est impliqué dans le développement du processus cancéreux dans un tel contexte métabolique.
Cela dit, on ne sait encore que peu de choses sur les mécanismes fondamentaux associés à l’obésité qui impactent le tissu adipeux et l’ensemble des cellules immunitaires (pas seulement les lymphocytes T CD8+) pour aboutir à une augmentation du risque de cancer.
Enfin, on ignore si l’obésité affecte un autre type d’immunothérapie anti-tumorale que celle reposant sur l’utilisation des inhibiteurs des checkpoints immunitaires, en l’occurrence les CAR-T cells, qui sont des lymphocytes T modifiés génétiquement dans le but de reconnaître puis éliminer les cellules cancéreuses. Cette stratégie d’immunothérapie vise à combattre le cancer en s’appuyant sur le propre système immunitaire du patient.
Une meilleure compréhension des divers effets de l’obésité sur le système immunitaire devrait, à terme, permettre d’améliorer les résultats de l’immunothérapie anti-tumorale.
Signalons pour conclure que ces nouvelles connaissances n’ont pu être acquises qu’avec l’aide de souris de laboratoire, ce qui montre l’importance cruciale de la recherche animale pour tenter de mieux comprendre les mécanismes complexes entre obésité, microbiote intestinal, immunité et cancer.
Marc Gozlan (Suivez-moi sur X, Facebook, LinkedIn, Mastodon, Bluesky)