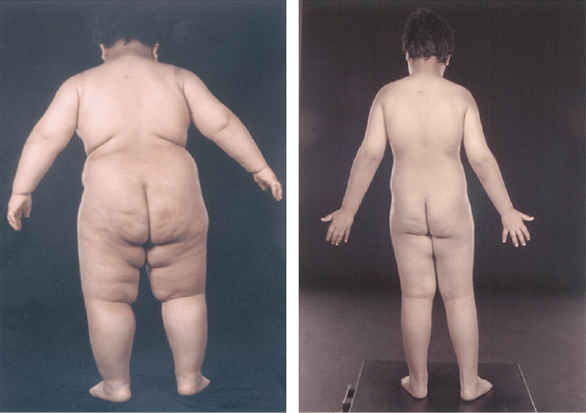
C’est l’histoire de deux enfants, une fillette de 2 ans et un garçon de 14 ans, atteints d’une forme rare et sévère d’obésité d’origine génétique, à début précoce, avec hyperphagie incontrôlable et troubles de la satiété. Issus de deux familles différentes [1], ces deux jeunes patients présentaient les caractéristiques d’un dysfonctionnement de la leptine, hormone produite par les adipocytes (ou cellules graisseuses). Leur cas est rapporté par des médecins et chercheurs allemands dans un article publié le 15 juin 2023 dans l’hebdomadaire médical américain The New England Journal of Medicine (NEJM)
Pour comprendre, il faut savoir que la leptine intervient dans la régulation de l’appétit, en signalant au niveau cérébral la quantité de tissu adipeux dans l’organisme, reflet de l’état des réserves énergétiques.
Rôle majeur de la leptine dans le contrôle de la prise alimentaire et de la dépense énergétique
De fait, l’une des voies clés impliquées dans les centres régulateurs du comportement alimentaire et du métabolisme est la voie de la leptine, dont l’interruption entraîne une dysrégulation du contrôle des signaux de faim et de satiété avec une consommation excessive de nourriture dès la petite enfance (hyperphagie insatiable). Dans un tel cas, l’obésité débute dès les premiers mois de vie.
Ces deux jeunes patients présentaient pourtant des taux sanguins élevés de leptine, laissant à penser que leur obésité pouvait être liée à un défaut de réponse de l’organisme à cette hormone.
La leptine agit en se liant à un récepteur présent à la surface de neurones situés dans une région du cerveau appelée hypothalamus. Centre de régulation énergétique, l’hypothalamus intègre en continu des informations sur le statut nutritionnel et énergétique de l’organisme humain. Le noyau arqué, situé à la base de l’hypothalamus, est le relais principal de l’action de la leptine au niveau cérébral. La liaison de la leptine à son récepteur cellulaire entraîne l’activation de neurones dits anorexigènes car ils inhibent la faim.
C’est une lignée de souris obèses, décrite pour la première fois en 1950, qui a ouvert la voie à l’exploration des causes des obésités d’origine génétique. En effet, en 1973, les travaux de Doug Coleman (Jackson Laboratory, Bar Harbor, Maine) ont permis de montrer que l’obésité de ces rongeurs a une base génétique. Deux décennies plus tard, le gène responsable est découvert. Baptisé Lep, il code pour la leptine. Chez l’homme, le déficit congénital en leptine est une maladie caractérisée par l’absence complète de leptine, responsable d’une obésité sévère à début précoce.
Une autre souche de souris, découverte il y a plus de 70 ans, présente une obésité associée à un diabète de type 2 (DT2). Cette lignée de rongeurs présente des mutations dans le gène codant le récepteur de la leptine (LEPR). On connaît aujourd’hui 38 variants pathologiques du gène du récepteur de la leptine (LEPR), responsables chez l’homme de la survenue d’une obésité sévère à début précoce et d’un DT2. Chez ces individus, on observe des taux élevés de leptine dans le sang, ces taux circulants reflétant une résistance à l’action de la leptine.
Mais revenons aux deux jeunes patients, âgés de 2 et 14 ans, décrits par une équipe de pédiatres allemands dans le NEJM. Ces deux enfants ne sont pas diabétiques. L’enfant de 2 ans a un indice de masse corporelle (IMC) à 31 et donc présente une obésité modérée (définie par un IMC supérieur ou égal à 30). L’adolescent, dont l’IMC est à 54, souffre d’obésité morbide (définie par un IMC supérieur ou égal à 40).
Jan-Bernd Funcke, Barbara Moepps et leurs collègues du département d’endocrinologie pédiatrique et de diabétologie de l’université d’Ulm ont vérifié que ces enfants n’étaient pas atteints d’une forme d’obésité génétique s’accompagnant de l’atteinte de plusieurs organes (obésité syndromique).
Ils ont ainsi exclu que ces enfants soient atteints du syndrome de Prader-Willi, qui représente la cause la plus fréquente d’obésité syndromique, c’est-dire d’une obésité associée à des signes évocateurs d’un trouble neuro-développemental et/ou de malformations congénitales. Dans le syndrome de Prader-Willi, le diagnostic est donc avant tout clinique, avant d’être confirmé par l’analyse génétique.
L’équipe de Martin Wabitsch a également écarté le diagnostic d’un syndrome de Bardet-Biedl, pathologie qui associe habituellement une obésité, une atteinte de la rétine (rétinopathie pigmentaire), la présence d’un ou plusieurs doigts surnuméraires situés à côté du petit doigt (polydactylie), une atteinte de la fonction rénale et des difficultés d’apprentissage. D’autres signes cliniques sont plus rares, tels que des anomalies neurologiques, un retard de langage, des troubles du comportement, une surdité, un diabète, une hypertension artérielle.
Le séquençage du gène Lep codant la leptine montre que les deux enfants sont porteurs de deux copies mutées de ce gène (mutation homozygote). Chez ces deux jeunes patients, on observe une absence totale de leptine normale. Ils ne produisent qu’une forme mutée de leptine.
Le garçon de 14 ans est porteur d’une mutation homozygote, avec substitution d’un acide aminé par un autre dans la protéine codée par ce gène. Il y a remplacement d’une proline par une lysine (mutation P64S). Quant à l’ADN de la fillette de 2 ans, il renferme une mutation homozygote différente dans le gène Lep, entraînant le remplacement d’une glycine par une sérine (G59S). Chacun des parents des deux enfants est porteur de la mutation en question à l’état hétérozygote (une seule copie du gène Lep est mutée).
Les scientifiques ont cherché à déterminer si la leptine mutée produite par ces enfants porteurs de la mutation P64S ou G59S est capable d’activer le récepteur de la leptine. En effet, des données de biochimie structurale semblaient indiquer que le remplacement d’un acide aminé par la sérine à ces emplacements précis au sein de la protéine de leptine était susceptible d’affecter la capacité de cette hormone à activer son récepteur.
Pour ce faire, les biologistes ont introduit dans l’ADN de cellules humaines l’une ou l’autre mutation (P64S ou G59S), puis ont ajouté au milieu de culture des concentrations croissantes de leptine normale (non mutée). Dans ces expériences in vitro, les cellules étaient donc exposées à une version mutée de la leptine et à la version normale de cette même hormone.
In vitro, la leptine mutée entrave l’action de la leptine normale
Il s’avère que la leptine mutée se fixe sur le même récepteur que la protéine leptine normale (non mutée), tout en empêchant que cette dernière puisse s’y fixer. En d’autres termes, la leptine mutée entre en compétition avec la leptine normale (non mutée). Les mutations P64S et G59S ont donc pour conséquence que la leptine mutée contrecarre l’activation du récepteur par la leptine normale. Les biochimistes parlent d’antagonisme compétitif quand il y a compétition entre deux molécules pour le même site de liaison sur un récepteur cellulaire.
Il apparaît donc que l’obésité sévère dont souffrent ces deux patients est causée par la présence d’une leptine capable d’agir comme un antagoniste de la leptine normale. La leptine mutée se lie bien au récepteur de la leptine (LEPR), mais ne déclenche qu’une activation marginale, voire inexistante, du récepteur. La liaison avec le récepteur LEPR n’est donc suivie d’aucun message parvenant à l’intérieur des cellules, alors même que la capacité de la leptine mutée à se lier au récepteur ne diffère pas de celle de la leptine normale (non mutée).
Il se trouve que l’on dispose d’une forme de leptine produite par génie génétique. Cette leptine recombinante, appelée métréleptine, est utilisée chez de rares patients atteints de déficit congénital en leptine par mutation du gène Lep. Dans cette indication, la posologie est de 0,02 à 0,04 mg/kg/jour, en injection sous-cutanée. Chez ces patients, l’efficacité du traitement est rapide, entraînant une normalisation de l’hyperphagie et la restauration de la sensation de satiété.
L’administration de leptine recombinante a été le premier exemple couronné de succès dans le traitement de l’obésité extrême en médecine de précision, qui consiste notamment en un traitement sur mesure de malades en tenant en compte du profil individuel génétique.
Les pédiatres allemands entreprennent alors de traiter les deux jeunes enfants en administrant des doses habituelles de leptine, à raison de 0,03 mg par kg de poids corporel. Sans succès.
Exploiter les résultats obtenus in vitro sur le plan thérapeutique
Au vu des résultats de leurs expériences menées in vitro en présence de la leptine mutée et normale, les chercheurs décident de fortement augmenter les doses de métréleptine afin de surmonter l’effet antagoniste de la leptine mutée produite par ces patients.
Pour l’adolescent de 14 ans, la dose de métréleptine a été augmentée à 0,14 mg par kg le deuxième jour de traitement et à 0,70 mg par kg le troisième jour (soit environ vingt-trois fois la dose habituelle). Pour l’enfant de 2 ans, la dose a été portée à 0,15 mg par kg le deuxième jour de traitement (soit cinq fois la dose standard de leptine recombinante).
Par ailleurs, afin de diminuer la production endogène de leptine mutée, ces enfants ont bénéficié d’une prise en charge nutritionnelle comportant des périodes de jeûne et la participation à des programmes d’activité physique.
Un poids qui se normalise au fil du temps
Les deux patients ont alors connu une normalisation des quantités de nourriture ingérée, une satiété et une perte pondérale très importante, après quoi les doses de métréleptine ont été réduites (après plus de quatre mois de traitement pour l’adolescent, après plus de huit mois pour la fillette).
L’IMC de l’adolescent, qui au départ était de 54, a chuté pour atteindre 26,9 au bout de 1888 jours (soit après un peu plus de cinq ans). Il est parvenu à perdre 49,9 kg et à atteindre un poids presque normal pour sa taille (94,1 kg). Quant à la petite fille de deux ans, son IMC qui était de 31,6 au départ est passé à 17,6 après 1260 jours (soit après trois ans et demi). Après avoir perdu 9,6 kg, l’enfant a retrouvé un poids normal, de 23,2 kg.
Comme on pouvait s’y attendre [2], des anticorps anti-métréleptine sont apparus chez les deux patients, mais sans que l’on observe, à aucun moment, une perte d’efficacité du traitement par la leptine recombinante.
En résumé, cette étude révèle, sur le plan fondamental, qu’une hormone mutée peut exercer une action antagoniste vis-à-vis de la forme normale de cette même hormone (ou de sa version thérapeutique, en l’occurrence la métréleptine, la leptine recombinante).
Elle démontre également, de façon magistrale, l’importance des études in vitro dans la compréhension de la physiopathologie de certaines formes d’obésité génétique. Pour ces deux jeunes patients atteints d’obésité à début précoce, cela a permis d’envisager une stratégie de traitement personnalisé. Ces résultats pourraient ouvrir de nouvelles perspectives thérapeutiques dans des obésités sévères avec hyperphagie impliquant la leptine.
Marc Gozlan (Suivez-moi sur Twitter, Facebook, LinkedIn, Mastodon)
[1] Les parents de la fillette de 2 ans sont cousins germains et d’origine arabe. Ceux de l’adolescent de 14 ans sont cousins de second degré (cousins issus de germains) d’origine européenne.
[2] La très grande majorité des patients (environ 90 %) traités par métréleptine développent des anticorps dirigés contre cette forme recombinante de la leptine. L’impact sur l’efficacité de la métréleptine reste cependant encore à établir.