Des chercheurs américains viennent de montrer que des neurones sensoriels situés dans des ganglions proches de la moelle épinière innervent le tissu adipeux et participent à son contrôle. Ce faisant, ces scientifiques ont découvert chez la souris une voie de communication jusqu’alors inconnue qui permet aux cellules adipeuses (ou adipocytes) de « parler » directement au cerveau.
Le tissu adipeux joue un rôle primordial dans l’équilibre énergétique de l’organisme, ce que l’on appelle l’homéostasie énergétique, qui elle-même intervient dans la régulation du poids corporel.
Blanc, brun, beige
Il existe deux types de tissu adipeux : le tissu adipeux blanc, qui stocke l’énergie (sous forme de triglycérides) et la restitue en fonction des besoins, et le tissu adipeux brun qui, lui, dissipe l’énergie stockée (sous forme d’acides gras) sous forme de chaleur, selon un processus appelé thermogenèse.
Récemment a émergé le concept de beigeing, défini comme l’émergence d’adipocytes bruns thermorégulateurs au sein du tissu adipeux blanc. La graisse a donc, pour ainsi dire, trois « couleurs » : le brun, le blanc et le beige. Les cellules adipocytaires beiges, qui renferment un plus grand nombre de mitochondries (organites intra-cellulaires jouant un rôle central dans le métabolisme énergétique cellulaire) que le tissu adipeux blanc, sont le plus souvent localisées au niveau du tissu adipeux sous-cutané[1].
On considère classiquement que le tissu adipeux envoie des signaux au cerveau en libérant des hormones dans la circulation sanguine. En retour, le cerveau régule le fonctionnement du tissu adipeux via des nerfs du système nerveux sympathique, qui libèrent des neurotransmetteurs (catécholamines) dans le tissu adipeux [2].
Jusqu’à présent, les études sur l’innervation du tissu adipeux se sont surtout concentrées sur l’innervation sympathique qui augmente la production de chaleur et le métabolisme lipidique. Le système sympathique joue ainsi un rôle majeur dans l’activation du tissu adipeux brun lors d’une exposition au froid. En revanche, on ne sait que très peu de choses sur l’innervation sensorielle du tissu adipeux et sur son rôle dans le métabolisme lipidique.
Innervation sensorielle du tissu adipeux
Pour comprendre, il importe de savoir que les neurones sensoriels sont situés dans des ganglions dorsaux rachidiens, encore appelés ganglions de la racine dorsale. Situé près de la moelle épinière, chaque ganglion constitue un renflement de la racine dorsale d’un nerf rachidien émergeant de la moelle épinière. Ces neurones, dits somatosensoriels, véhiculent jusqu’au cerveau les informations sensitives provenant de la peau et des muscles, telles que la douleur, le toucher, la proprioception (position des différentes parties du corps).
L’étude de l’innervation sensorielle du tissu graisseux est particulièrement difficile dans la mesure où l’on manque d’outils expérimentaux permettant de cibler et de manipuler l’activité de ces neurones. La grande nouveauté du travail, présenté par des chercheurs en neurosciences de Scripps Research (La Jolla, Californie) et publié le 15 septembre 2022 dans la revue Nature, tient au fait qu’ils ont développé de nouvelles stratégies pour manipuler, chez la souris, les fibres nerveuses sensorielles qui innervent le tissu adipeux.
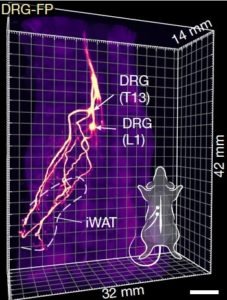
Visualiser le parcours des projections axonales des ganglions dorsaux rachidiens jusqu’aux adipocytes
La première technique, baptisée HYBRID (hydrogel-based renforcement of three-dimensional imaging solvent-cleared organs), permet de rendre transparents tous les tissus d’une souris. En associant cette méthode à la microscopie (basée sur l’illumination sélective d’un seul plan par un faisceau lumineux), les chercheurs californiens ont réussi à suivre, en 3D dans un bloc de tissu adipeux blanc au niveau de l’aine des rongeurs, le cheminement des prolongements de neurones issus des ganglions dorsaux rachidiens. En utilisant une protéine fluorescente capable de marquer les neurones ainsi que leurs projections, les terminaisons de ces projections ont ainsi pu être visualisées. Les chercheurs ont observé que celles-ci cheminent le long des vaisseaux sanguins et terminent leur parcours en établissant un contact étroit avec des cellules adipeuses individuelles, ce qui montre donc sans ambiguïté que le tissu adipeux est directement innervé par des neurones somatosensoriels issus de ganglions dorsaux rachidiens.
Yu Wang, Li Ye et leurs collègues du Scripps Research, en association avec des chercheurs du Howard Hugues Medical Institute (Chevy Chase, Maryland), ont également développé une méthode génétique pour cibler spécifiquement les neurones sensoriels dont les projections pénètrent dans le tissu adipeux.
Ces scientifiques ont ainsi créé un vecteur viral exprimant un gène codant pour une toxine ou une protéine fluorescente. Ils ont généré deux types de virus, l’un qui tue les neurones somatosensoriels des ganglions de la racine dorsale (tout en épargnant les neurones responsables de l’innervation sympathique) et un autre qui, lui, laisse intacts les neurones sensoriels. Cette technique d’ablation sélective de neurones sensoriels spécifiquement au sein du tissu adipeux a été baptisée ROOT (retrograde vector optimized for organ tracing).
Il s’avère que la destruction des neurones des ganglions de la racine dorsale qui innervent le tissu adipeux blanc entraîne, dans les cellules graisseuses, une augmentation de l’expression de gènes typiquement activés par les neurones du système nerveux sympathique, notamment ceux impliqués dans la conversion du tissu adipeux blanc en tissu adipeux beige (gènes à la fois impliqués dans le métabolisme des lipides, ainsi que dans la thermogenèse induite par le froid). De fait, les souris dont les neurones sensoriels étaient détruits avaient une température corporelle plus élevée, un résultat en faveur d’une thermogenèse accrue dans le tissu adipeux blanc.
Dans le tissu adipeux, l’innervation sensorielle s’oppose aux effets du système sympathique
Les résultats de cette expérience de dénervation sensorielle suggèrent donc que les neurones somatosensoriels issus du ganglion de la racine dorsale servent à contrer l’activation du système nerveux sympathique dans le tissu adipeux. En d’autres termes, les neurones issus des ganglions dorsaux rachidiens agissent comme des freins sur le système sympathique. Il apparaît donc que les neurones sensoriels et sympathiques agissent de concert pour contrôler le fonctionnement du tissu adipeux.
Enfin, lorsque les chercheurs ont réalisé l’ablation bilatérale de l’innervation sensorielle du tissu adipeux blanc, ils ont observé un enrichissement en adipocytes beiges et une augmentation de l’expression des gènes stimulant la thermogenèse. Enfin, lorsque les chercheurs ont procédé à une dénervation sensorielle du tissu adipeux chez des souris alimentées avec une nourriture riches en graisses, ils ont observé que ces rongeurs avaient une meilleure tolérance au glucose que les animaux contrôles. Ces résultats semblent indiquer que l’ablation sensorielle du tissu adipeux protège les souris d’une intolérance au glucose induite par l’alimentation via des mécanismes impliquant le tissu adipeux beige.
Au total, les scientifiques ont donc clairement montré que les neurones somatosensoriels des ganglions de la racine dorsale innervent le tissu adipeux et qu’il existe par conséquent une voie de communication par lequel le cerveau peut recevoir en retour des informations sur l’état métabolique du tissu graisseux. Pour le dire autrement, le tissu adipeux et le cerveau se parlent [3].
Le système nerveux central surveille et contrôle le tissu adipeux
Selon les chercheurs, ces résultats permettent donc de mieux comprendre « comment le système nerveux central surveille et contrôle la fonction du tissu adipeux, soulignant l’importance d’une branche sous-estimée de la communication cerveau-corps ».
Il reste néanmoins à déterminer quels sont les stimuli endogènes (chimiques et/ou mécaniques, voire thermiques) qui stimulent les projections des neurones somatosensoriels qui innervent le tissu adipeux sous-cutané, mais également le tissu graisseux de différents organes [4]. On ignore encore tout de la nature de ces signaux. S’agit-il de substances provenant de la dégradation des lipides (produits de la lipolyse) ou d’autres molécules libérées au niveau du tissu adipeux ? Certains troubles métaboliques pourraient-ils être associés à une altération de l’innervation sensorielle ou sympathique du tissu adipeux ?
L’identification de ces stimuli endogènes permettrait de mieux appréhender le rôle de l’innervation sensorielle du tissu adipeux dans le maintien de l’homéostasie énergétique.
Futures perspectives en recherche et en thérapeutique
Les nouveaux outils développés par les chercheurs américains devraient permettre de mieux étudier le rôle des neurones sensoriels dans l’interoception. Autrement dit, de mieux comprendre la perception par le système nerveux des modifications ou signaux provenant des organes internes. D’autres techniques devront cependant être développées afin d’étudier, cette fois-ci en temps réel, l’activité des neurones sensoriels dans les différents tissus adipeux.
L’existence d’une innervation sensorielle du tissu adipeux conduit à se poser plusieurs questions. Est-il possible que l’information sensorielle provenant d’un dépôt adipeux soit capable de moduler le fonctionnement d’autres zones graisseuses situées plus haut, ou plus bas, le long de la moelle épinière ? Un dialogue existe-t-il entre des tissus adipeux situés à différents niveaux ?
Enfin et surtout, à ce stade des recherches, il importe de déterminer si l’innervation sensorielle du tissu adipeux joue le même rôle chez l’homme que chez la souris. Si tel est le cas, on peut penser qu’il puisse être, un jour, possible de développer des techniques ciblant les neurones somatosensoriels pour traiter l’obésité et d’autres désordres métaboliques.
Marc GOZLAN (Suivez-moi sur Twitter, Facebook, LinkedIn)
[1] Ces adipocytes blancs « brunis » sont appelés adipocytes beiges. Ces cellules adipeuses enrichies en mitochondries expriment la protéine découplante UCP (uncoupling-protein-1), localisée au niveau de la membrane interne mitochondriale. L’obésité et le vieillissement sont associés à une perte de fonctionnalité des tissus adipeux bruns et beiges.
[2] On sait que l’innervation autonome sympathique, révélée par un immunomarquage dirigé contre la tyrosine hydroxylase (enzyme de synthèse de la noradrénaline), est abondante et se localise à la fois entre les adipocytes blancs et beiges et autour des vaisseaux sanguins.
[3] Il avait déjà été montré une voie de communication entre tissu adipeux blanc et système nerveux central. En 2014, l’équipe de Timothy Bartness (Georgia State University, Atlanta) avait montré, après avoir injecté dans le tissu adipeux blanc de rongeurs des vecteurs viraux fluorescents marquant spécifiquement des neurones (traceurs transportés soit de manière rétrograde, soit antérograde), que des cellules nerveuses cérébrales étaient marquées par ces deux traceurs (notamment au niveau du noyau paraventriculaire). Ces travaux pionniers avaient donc montré une remontée d’informations sensorielles au cerveau en provenance du tissu adipeux.
[4] Concernant les signaux thermiques ou mécaniques en question, il pourrait s’agir d’une augmentation de la température après activation de la thermogenèse et de la pression exercée localement par l’hypertrophie du tissu adipeux.