Le diabète de type 2 (DT2), maladie complexe et multifactorielle, se caractérise par une glycémie élevée à jeun ou après les repas mais également par une altération de la capacité du muscle squelettique à capter le glucose sous l’action de l’insuline. En effet, le muscle squelettique est le principal tissu utilisant le glucose en réponse à l’insuline et constitue le site majeur de l’insulinorésistance dans le DT2.
À ce jour, les mécanismes moléculaires précis qui sous-tendent l’insulinorésistance musculaire restent largement méconnus, alors même que le muscle squelettique joue un rôle majeur dans la régulation glycémique postprandiale. Après ingestion, environ 80 % du glucose est en effet capté par le muscle squelettique via une absorption insulino-dépendante. Bien que ce mécanisme soit bien documenté, il n’existe à ce jour aucune stratégie pharmacologique visant spécifiquement à améliorer la sensibilité à l’insuline dans ce tissu.
Grâce à une étude de très grande ampleur de l’ensemble des protéines musculaires (analyse protéomique), il a été possible d’identifier des signatures moléculaires spécifiques associées à ce dysfonctionnement.
Ce décryptage inédit ouvre de nouvelles pistes pour mieux comprendre la diversité des formes de diabète et envisager des traitements ciblés sur le muscle, organe clé du métabolisme du glucose. Comprendre les signatures moléculaires de l’insulinorésistance et leur lien avec les caractéristiques cliniques individuelles est essentiel pour faire progresser la médecine de précision dans le diabète de type 2.
Analyser le protéome et le phosphoprotéome musculaire
Pour comprendre, quelques mots sur le protéome, terme désignant l’ensemble des protéines exprimées dans une cellule, mais aussi sur le phosphoprotéome. Il faut savoir que les protéines peuvent être modifiées après leur synthèse par la cellule. L’une de ces modifications consiste en l’ajout d’un groupe phosphate à certaines d’entre elles, un processus appelé phosphorylation. Ce mécanisme, orchestré par des enzymes nommées kinases, agit comme un interrupteur moléculaire : il active ou désactive certaines fonctions des protéines, influence leur localisation, leur interaction avec d’autres molécules. Le phosphoprotéome musculaire est l’ensemble des protéines du muscle qui portent un groupe phosphate.
Publiée en ligne le 27 mai 2025 dans la revue Cell, cette étude a consisté à analyser conjointement le protéome et le phosphoprotéome musculaire d’une cohorte de plus de 120 individus, hommes et femmes, avec une tolérance normale au glucose ou vivant avec un diabète de type 2. Tous ces participants étaient rigoureusement caractérisés sur le plan clinique et métabolique. Cette approche a permis d’identifier des signatures moléculaires personnalisées associées à l’insulinorésistance et au diabète de type 2.
Cette étude a été menée par des chercheurs danois (Centre de recherche métabolique fondamentale de la Fondation Novo Nordisk de l’université de Copenhague) et suédois (Institut Karolinska, Stockholm). Elle comportait deux cohortes : l’une de 77 individus (dont 34 diabétiques de type 2) et une seconde dite de validation, composée de 46 personnes (dont 34 vivant avec un DT2).
Tous les participants ont bénéficié d’un phénotypage métabolique approfondi. En d’autres termes, plusieurs paramètres cliniques et biologiques ont été évalués pour chacun d’eux, à savoir la glycémie à jeun, l’hémoglobine glyquée (HbA1c, reflet de la glycémie des trois derniers mois), l’indice HOMA1-1R (estimation de l’insulinorésistance à partir du taux d’insuline à jeun et du glucose), et la mesure de la sensibilité à l’insuline par la technique du clamp euglycémique-hyperinsulinémique. Considérée comme la méthode de référence pour mesurer la sensibilité à l’insuline in vivo, cette technique consiste à perfuser de l’insuline à un débit fixe, associée à une perfusion variable de glucose, adaptée de façon à obtenir une glycémie normale et constante. Le résultat est ce qu’on appelle la « valeur M ». Des biopsies musculaires ont été réalisées à jeun et pendant le clamp euglycémique-hyperinsulinémique.
Cette étude a montré que l’amplitude de sensibilité à l’insuline, mesurée par la « valeur M », peut varier d’un facteur 5 chez les individus à tolérance glycémique normale et d’un facteur 16 chez les personnes atteintes de diabète de type 2. Il a été montré que certaines personnes atteintes de DT2 présentent même une sensibilité à l’insuline plus élevée que certaines personnes ayant une tolérance normale au glucose.
Intrigués par l’hétérogénéité observée, les chercheurs scandinaves ont analysé le protéome et le phosphoprotéome du muscle squelettique. Ces analyses ont été réalisées par spectrométrie de masse à haute sensibilité. Cela a conduit à quantifier 3 038 protéines et environ 15 000 sites de phosphorylation dans le muscle squelettique et a ensuite servi de données de base à l’analyse bioinformatique.
Les signatures moléculaires du muscle squelettique reflètent le mieux la sensibilité à l’insuline
Il s’avère que les profils du protéome et du phosphoprotéome musculaire ne correspondent pas forcément à la classification « diabétique » ou « non diabétique », mais évoluent de façon graduelle selon le degré réel de sensibilité à l’insuline. Les données issues du protéome et du phosphoprotéome musculaire se sont finalement révélées plus performantes pour prédire le niveau de sensibilité à l’insuline que le simple fait d’appartenir à l’un ou l’autre groupe clinique (« diabétique » ou « non diabétique »).
Pour mieux comprendre le rôle du muscle squelettique dans la régulation du glucose, les chercheurs ont ensuite comparé le protéome (à jeun) et le phosphoprotéome (à jeun et après stimulation par l’insuline) avec différents paramètres calculés sur la base du taux d’insuline (tels que l’insulinémie à jeun, l’indice HOMA1-IR, la valeur M).
Résultats : le protéome musculaire était surtout lié aux mesures dépendantes de l’insuline, comme l’insulinémie à jeun, l’indice HOMA1-IR (qui reflète la résistance à l’insuline) et la valeur M. En revanche, il présente peu ou pas de lien avec la glycémie à jeun ou l’hémoglobine glyquée (HbA1c). De son côté, le phosphoprotéome, que ce soit à jeun ou après stimulation à l’insuline, est plus fortement associé à la valeur M que toutes les autres mesures, y compris le HOMA1-IR.
Ces données mettent en évidence le rôle central du muscle squelettique – et en particulier l’importance de la phosphorylation – dans la sensibilité de l’organisme à l’insuline.
Les chercheurs ont étudié l’influence du phosphoprotéome musculaire à jeun (c’est-à-dire en l’absence de stimulation par l’insuline). Pour ce faire, ils ont comparé les échantillons de muscle squelettique prélevés chez des patients à jeun atteints de DT2 et des personnes présentant une tolérance normale au glucose.
Plusieurs sites de phosphorylation associés à l’insulinorésistance même à jeun
L’un des résultats inattendus concerne l’analyse du phosphoprotéome en condition de jeûne. Traditionnellement, les chercheurs s’intéressent aux modifications intracellulaires déclenchées par l’administration d’insuline, autrement dit à la réponse des tissus cibles à cette hormone. Or, dans cette étude, les scientifiques ont découvert que certaines phosphorylations anormales étaient déjà présentes à jeun chez les personnes insulinorésistantes, donc en l’absence d’insuline injectée.
Les chercheurs ont identifié 118 sites de phosphorylation corrélés à la sensibilité à l’insuline à jeun, contre seulement 66 sites détectés exclusivement après stimulation insulinique.
Ces données indiquent que la majorité des phosphorylations associées à l’insulinosensibilité sont indépendantes d’une stimulation aiguë par l’insuline. En clair, le fait que l’on observe davantage de résidus phosphorylés sur les protéines musculaires à l’état basal qu’après stimulation suggère que la phosphorylation repose en grande partie sur des mécanismes distincts de l’action immédiate de l’insuline.
Selon les auteurs, « cela suggère que le milieu systémique semble offrir un environnement qui déclenche des modifications du phosphoprotéome même à jeun. Ainsi, certaines hormones et métabolites liés à l’état diabétogène pourraient, même à l’état de jeûne, exercer une influence permissive qui modifie le phosphoprotéome et reflète le degré de sensibilité à l’insuline ».
À l’inverse, d’autres marqueurs cliniques tels que l’HbA1c, la glycémie à jeun ou l’insulinémie à jeun semblent davantage refléter des processus biologiques se déroulant dans d’autres organes, comme le foie ou le pancréas.
Hyperactivation de la voie JNK-p38 dans le muscle insulino-résistant
Les analyses révèlent par ailleurs une hyperactivation de l’enzyme JNK (c-Jun N-terminal kinase) dans le muscle insulinorésistant. Les chercheurs ont observé l’activation d’une chaîne de réactions biochimiques intracellulaires, en particulier la voie de signalisation JNK-p38. Cette voie émerge comme un axe majeur de signalisation altérée dans l’insulinorésistance musculaire. Son activation excessive pourrait être le reflet d’un micro-environnement immunologique anormal autour du muscle squelettique.
Identification d’un site crucial de phosphorylation dans le muscle
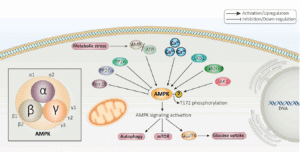
Parmi les nombreux sites de phosphorylation identifiés, l’un retient particulièrement l’attention : le site S65 (acide aminé sérine en position 65) situé sur la sous-unité γ3 de l’AMPK, une protéine-clé impliquée dans la régulation du métabolisme énergétique. Ce site présente deux particularités : il est spécifique à l’espèce humaine (Homo sapiens) et exclusivement exprimé dans le muscle squelettique.
Les chercheurs ont montré que la phosphorylation de ce site est fortement corrélée à la sensibilité à l’insuline. Elle est régulée par une kinase, MAPKAPK2, située en aval de la voie de signalisation p38/JNK.
« De par la spécificité tissulaire de la sous-unité γ3 de l’AMPK, le site S65 pourrait constituer une cible thérapeutique prometteuse pour améliorer la sensibilité à l’insuline du muscle squelettique, tout en réduisant le risque d’effets secondaires dans d’autres organes », estime l’équipe dirigée par Anna Krook (Stockholm) et Atul Deshmukh (Copenhague).
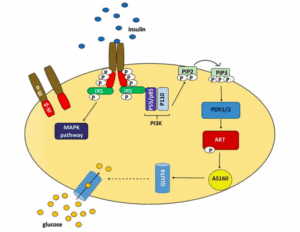
Par ailleurs, cette étude remet en question la vision classique d’une insulinorésistance généralisée affectant uniformément toute la cascade de signalisation intracellulaire. Pour comprendre, il faut savoir qu’une fois que l’insuline se lie à son récepteur, il se produit une série de réactions biochimiques qui conduit à l’activation de l’enzyme AKT.
Or, les données révèlent que l’activité de la voie AKT peut être partiellement conservée, même en contexte d’insulinorésistance. Ce constat suggère soit une préservation relative de cette branche de la signalisation, soit l’intervention de mécanismes compensatoires faisant appel à d’autres enzymes encore inconnues, telles que des kinases ou des phosphatases.
Ces résultats mettent en lumière la complexité et l’hétérogénéité des mécanismes moléculaires à l’origine de l’insulinorésistance musculaire.
Des signatures moléculaires personnalisées associées à l’insulinorésistance
« Ces observations soulignent que l’insulinorésistance n’affecte pas de manière uniforme toutes les composantes des voies de signalisation. Cela implique qu’il faut revoir notre manière de comprendre les dérèglements de ces voies dans le contexte de l’insulinorésistance », écrivent Jeppe Kjærgaard et ses collègues.
Alors que la plupart des personnes atteintes de diabète de type 2 présentent une diminution globale de la sensibilité à l’insuline, souvent associée à un affaiblissement de la signalisation insulinique dans le muscle squelettique, cette étude montre que ce modèle n’est pas universel. Chez certains individus, malgré une forte insulinorésistance, l’analyse du phosphoprotéome musculaire après stimulation insulinique révèle que certaines composantes de la voie de signalisation fonctionnent encore normalement, tandis que d’autres sont altérées.
Ces données confirment la nature complexe et hétérogène des altérations de signalisation intracellulaire dans l’insulinorésistance musculaire.
Selon les auteurs, ces résultats suggèrent que renforcer globalement la réponse du muscle squelettique à l’insuline pourrait ne pas suffire. Une approche plus fine, ciblant précisément certains maillons spécifiques de la chaîne de signalisation, pourrait s’avérer plus efficace pour obtenir des effets métaboliques bénéfiques.
Différences du phosphoprotéome musculaire entre hommes et femmes
Les chercheurs ont également mis en évidence des différences notables du protéome et du phosphoprotéome musculaire entre hommes et femmes. Chez les femmes, on observe une plus grande dépendance au métabolisme lipidique, tandis que les hommes mobilisent davantage la voie glycolytique. Toutefois, malgré ces divergences métaboliques, les mécanismes d’insulinorésistance apparaissent globalement similaires dans les deux sexes.
Bien que cette étude repose sur deux cohortes totalisant plus de 120 participants, elle ne peut à elle seule refléter toute la diversité des profils de patients atteints de diabète de type 2. Par ailleurs, de nombreux déterminants de l’insulinorésistance, qu’ils soient génétiques, comportementaux ou environnementaux, n’ont pas été intégralement pris en compte. Des travaux complémentaires seront nécessaires notamment pour mieux cerner le rôle du site S65 de la sous-unité AMPKγ3 dans la régulation du métabolisme glucidique et de la sensibilité à l’insuline.
Une hétérogénéité moléculaire à mieux prendre en compte
En utilisant une approche protéomique personnalisée, cette étude a permis de mettre en lumière des aspects jusqu’alors méconnus de l’insulinorésistance musculaire et d’identifier certaines voies moléculaires impliquées dans ce processus. En révélant des signatures moléculaires spécifiques, elle souligne l’hétérogénéité du diabète de type 2, un aspect qu’il conviendrait d’intégrer aux futures classifications diagnostiques.
Enfin, ces résultats ouvrent la voie à des stratégies thérapeutiques plus ciblées et personnalisées, adaptées aux signatures moléculaires, dans la prise en charge du diabète de type 2.