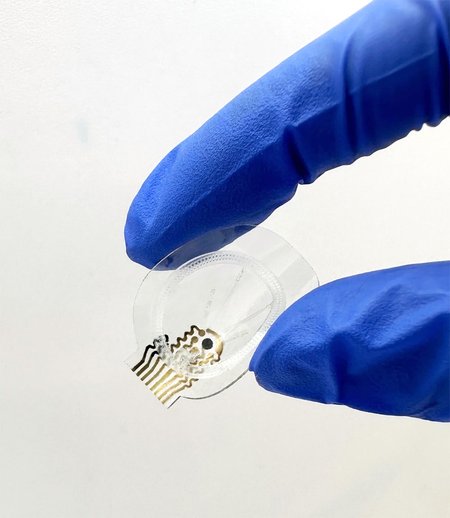
Des chercheurs du California Institute of Technology (Caltech, Pasadena) ont annoncé avoir développé un dispositif innovant capable de recueillir et analyser en continu le liquide suintant d’une plaie chronique, l’exsudat. Ce pansement portable surveille en temps réel ce liquide lentement sécrété par la plaie.
L’exsudat, indicateur de l’état de la plaie
Lorsqu’une plaie se forme, une inflammation localisée en résultant augmente la perméabilité des capillaires sanguins, permettant à un liquide séreux transparent, l’exsudat, de s’échapper dans le lit de la plaie.
Ce liquide joue un rôle crucial dans la cicatrisation, en maintenant un équilibre hydrique, en apportant des nutriments et en modulant la réponse immunitaire. Cependant, dans les plaies chroniques, l’exsudat peut être produit de manière excessive, souvent à cause d’une inflammation persistante.
Mesurer les espèces réactives de l’oxygène et de l’azote dans l’exsudat
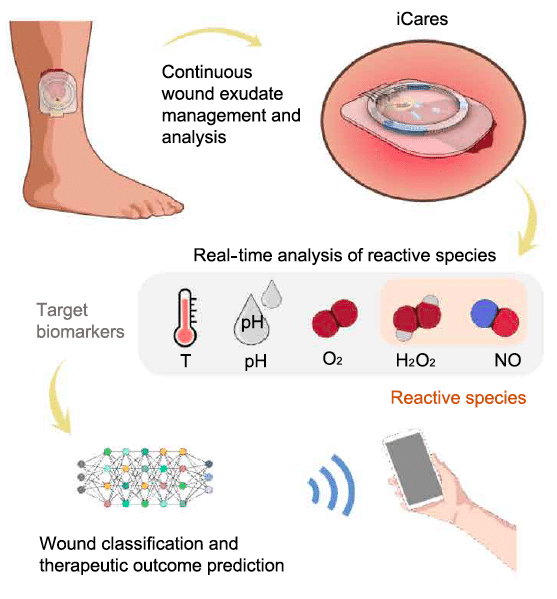
De couleur ambrée ou jaune paille, l’exsudat renferme des protéines, des cellules mortes et des débris cellulaires. Il contient également du monoxyde d’azote (NO), du peroxyde d’hydrogène (H₂O₂), de l’oxygène (O₂). Ces molécules, que l’on désigne sous l’appellation « espèces réactives de l’oxygène et de l’azote », sont des indicateurs indirects de la perfusion (formation de nouveaux vaisseaux sanguins et circulation locale), de l’inflammation et du contrôle des infections des tissus lésés.
Contrairement à d’autres liquides corporels, l’exsudat s’écoule très lentement – entre 1 et 10 microlitres par centimètre carré et par heure – ce qui complique son prélèvement et son analyse. Sa faible quantité rend aussi difficile la distinction entre exsudat récent et plus ancien.
Dans un article publié en avril 2025 dans la revue Science Translational Medicine, les chercheurs de Caltech annoncent avoir développé un pansement conçu pour prélever et analyser l’exsudat en continu in situ, c’est-à-dire directement dans la plaie.
Analyser l’exsudat en continu in situ
Les plaies chroniques représentent un défi majeur de santé publique à l’échelle mondiale. Rien qu’aux États-Unis, les organismes fédéraux d’assurance maladie (Medicare et Medicaid) dépensent plus de 28 milliards de dollars par an pour traiter ces plaies, un montant qui devrait continuer d’augmenter en raison du nombre croissant de personnes atteintes de diabète, d’obésité, de cancer ou d’autres comorbidités.
Les plaies chroniques cicatrisent difficilement, altèrent la qualité de vie des patients et génèrent des coûts importants pour les systèmes de santé. Pouvoir évaluer précisément l’évolution de la cicatrisation est essentiel pour adapter les soins à chaque patient, intervenir au bon moment, raccourcir les délais de guérison et améliorer le pronostic.
En 2023, cette même équipe de Caltech avait développé un pansement intelligent capable de fournir des données en temps réel sur les plaies chroniques dans des modèles animaux, tout en accélérant le processus de guérison grâce à l’application de médicaments ou de champs électriques pour stimuler la croissance des tissus.
Un dispositif microfluidique intégré dans un pansement adhésif
Aujourd’hui, Canran Wang, Wei Gao et leurs collègues de Caltech, en collaboration avec des chercheurs de la faculté de médecine Keck de l’université de Californie du sud (Los Angeles), ont donc franchi une nouvelle étape en créant un pansement capable de prélever en continu l’exsudat d’une plaie chronique pour analyser certains biomarqueurs en temps réel.
Baptisé Icares, ce dispositif recourt à l’électronique et à la microfluidique, une technologie reposant sur des écoulements liquides de très faibles volumes pour réaliser l’analyse dans des minicompartiments. L’ensemble du dispositif est intégré dans un pansement adhésif transparent standard (Tegaderm).
Un système sans pompe pour collecter, transporter et analyser l’exsudat
L’appareil fonctionne sans pompe et repose sur une série de trois modules microfluidiques innovants.
Tout d’abord, une membrane favorise l’entrée de l’exsudat dans le dispositif. Ensuite, un canal, inspiré des épines de cactus capables de capter l’humidité, guide ce liquide vers les capteurs. Enfin, une structure évacue le liquide après analyse dynamique du flux liquidien. Celle-ci crée une force capillaire directionnelle qui évacue automatiquement l’ancien liquide hors du réservoir de mesure, ce qui améliore grandement la précision des mesures.
Des nanocapteurs pour surveiller les espèces réactives de l’oxygène et de l’azote
Le système intègre un réseau de capteurs souples à l’échelle nanométrique, capable de mesurer plusieurs indicateurs clés directement sur la plaie : des espèces chimiques réactives comme le monoxyde d’azote (NO), le peroxyde d’hydrogène (H₂O₂) et l’oxygène (O₂), mais aussi le pH et la température.
Afin d’assurer une surveillance des espèces réactives de l’oxygène et de l’azote, avec transmission sans fil, en continu et sur une longue durée, l’ensemble du système a été assemblé avec un circuit électronique imprimé destiné à collecter, traiter et transmettre les données.
Testé chez des souris diabétiques
iCares a été testé chez des souris diabétiques, le dispositif étant appliqué sur une plaie située sur leur dos. La composition de l’exsudat a été évaluée avant et après une infection, puis après traitement antibiotique. Vingt-quatre heures après l’infection, les chercheurs ont observé une augmentation générale de la température, du pH et du taux de H₂O₂ ainsi qu’une légère diminution de ces valeurs après traitement.
Le dispositif a également permis de détecter des signes précoces d’infection. Ainsi, bien qu’aucune infection visible ne soit apparue au site de la plaie dans les 24 heures suivant une inoculation de la plaie par des bactéries, des changements importants dans les signaux des capteurs ont indiqué les premières étapes d’une infection. Des élévations de la température, du pH et du taux de H₂O₂ ont été observées dans les premières 24 heures après inoculation bactérienne.
Un traitement antibactérien immédiat a permis une guérison rapide de la plaie et a empêché la progression de l’infection, contrairement aux souris chez lesquelles le traitement avait été retardé et chez lesquelles des infections graves se sont développées. Les chercheurs ont par ailleurs observé que la température, le pH et la concentration de H₂O₂ revenaient progressivement vers la normale, ce qui indiquait l’efficacité du traitement.
Ces résultats suggèrent que ce dispositif peut détecter précocement des changements pathologiques, comme une infection avant l’apparition de symptômes visibles, permettant ainsi une intervention rapide et la prévention de complications.
Évaluation chez vingt patients
Les chercheurs ont évalué l’utilisation de leur dispositif portable auprès de 20 patients souffrant de lésions chroniques des membres inférieurs, non cicatrisantes, causées par une insuffisance veineuse ou un diabète. Ce dispositif portable a également été évalué chez deux patients avant et après une intervention de chirurgie vasculaire.
Les chercheurs ont développé des algorithmes d’apprentissage automatique pour évaluer les données des capteurs multiparamétriques. Ces données, combinées à l’analyse par intelligence artificielle, ont permis de classer avec précision l’état clinique des plaies et d’estimer les délais de cicatrisation.
En s’appuyant sur les données cliniques et les mesures transmises par le dispositif iCares, les chercheurs ont montré que le diabète, l’O₂ et le H₂O₂ étaient déterminants pour la classification des plaies, alors que la maladie artérielle périphérique, la surface de la plaie, le pH et le NO étaient des paramètres clés pour estimer le temps de cicatrisation.
Chez les deux patients opérés, des variations des marqueurs physicochimiques (hausse de l’O₂ et du NO, baisse du pH) ont été observées après l’intervention. Des modèles d’intelligence artificielle (apprentissage automatique) ont été utilisés pour relier les données cliniques du patient aux mesures des capteurs, révélant des relations complexes entre les différentes caractéristiques des patients et les biomarqueurs liés à la cicatrisation des plaies. À ce jour, les corrélations entre l’état de la plaie et ces différents paramètres restent incomplètement établies.
Ces données préliminaires prometteuses devront être validées par des équipes indépendantes sur un groupe plus important de patients et sur d’autres types de plaies (escarres, brûlures) pour s’assurer qu’elles sont fiables et reproductibles.
Combiner données du dispositif et intelligence artificielle
L’évaluation clinique d’une plaie (classification, estimation du temps de guérison et de la profondeur de la plaie) dépend souvent de l’expérience du clinicien et peut parfois nécessiter l’avis de plusieurs spécialistes pour être cohérente. Combiné à des algorithmes d’apprentissage automatique, le système iCares pourrait permettre d’évaluer, plus objectivement et en temps réel, l’évolution du processus de cicatrisation chez des patients souffrant de plaies chroniques et ainsi mieux guider les choix thérapeutiques.
Ce système microfluidique a néanmoins ses limites. Le pansement iCares peut être produit rapidement et à faible coût, notamment grâce à l’impression jet d’encre, la gravure laser et l’impression 3D. Mais pourrait-t-il être produit à grande échelle ? La question se pose dans la mesure où le processus d’assemblage nécessite un alignement précis et des opérations manuelles. Cette complexité pourrait poser des défis pour une production de masse, reconnaissent les auteurs.
Une autre limite du dispositif ICares mérite d’être mentionnée. Ce système est principalement conçu pour la surveillance de l’évolution d’une plaie et ne comprend pas de module de traitement intégré. Or on sait que l’oxygène joue un rôle crucial dans la cicatrisation des plaies en améliorant la circulation locale. Une oxygénation insuffisante peut gravement entraver la cicatrisation des plaies en limitant la respiration cellulaire et la production d’énergie. « À l’avenir, l’intégration de composants thérapeutiques, tels que la délivrance contrôlée d’O₂ ou de médicaments, pourrait améliorer encore la fonctionnalité du système et améliorer les résultats de la cicatrisation des plaies », déclarent les auteurs.
Dernière limite du système, également soulignée par ses développeurs : bien que conçu pour être flexible, ce dispositif a une forme fixe, ce qui limite sa capacité à s’adapter aux plaies de profondeurs variables, ayant des contours irréguliers ou dont la conformation évolue pendant la cicatrisation. Cette contrainte pourrait réduire son emploi dans certains types de plaies.
Pour pallier ce problème, des chercheurs du département de génie électrique et informatique de l’université d’État de Caroline du Nord ont développé un pansement intelligent intégrant des électrodes capables de changer de forme et ainsi s’adapter à des surfaces complexes, irrégulières ou mouvantes sans perdre leurs propriétés fonctionnelles. Cela signifie qu’elles peuvent épouser les contours d’une plaie profonde et complexe. Ici, le pansement ne vise pas à mesurer des marqueurs physiochimiques pour classifier la cicatrisation des plaies mais a pour objectif de délivrer une stimulation électrique au sein de la plaie. On parle ici d’électrothérapie, technique qui consiste à appliquer un champ électrique pour favoriser la cicatrisation.
Ces chercheurs ont ainsi développé un pansement innovant, sans composant électronique, activé par l’eau. Ce dispositif fonctionne même dans des conditions difficiles, là où beaucoup de traitements échouent. Il repose sur une batterie souple, associée à une paire d’électrodes de stimulation. L’ajout d’eau active la batterie, générant un champ électrique radial autour de la plaie.
Des expériences conduites chez des souris diabétiques ont montré que ce pansement accélère la fermeture des plaies et favorise la cicatrisation, en augmentant l’épaisseur de l’épiderme, en modulant l’inflammation et en stimulant la formation de nouveaux vaisseaux (angiogenèse).
Ces résultats suggèrent que ce pansement, ne comportant pas d’électronique et seulement activé par l’eau, représenterait une solution pratique et efficace pour le traitement des plaies chroniques.

La grande originalité de ce dispositif, dont les résultats ont été publiés en août 2024 dans la revue Science Advances, tient à la forme des électrodes de stimulation. Elle est inspirée du kirigami, art du découpage du papier dans la culture japonaise.
Ces électrodes peuvent s’adapter mécaniquement aux plaies présentant des formes courbes ou complexes. Elles peuvent aussi supporter d’importantes déformations. Le dispositif comprend une électrode externe en serpentin et une électrode interne en forme de spirale.
Pour conclure, signalons que d’autres pansements intelligents reposent, eux, sur l’utilisation de matériaux triboélectriques capables de transformer les mouvements biomécaniques du corps humain en électricité.
On le voit, l’inventivité des concepteurs de pansements intelligents ne cesse de repousser les frontières de la prise en charge des plaies chroniques. L’avenir de ce domaine repose sur l’émergence de dispositifs innovants, intégrant des technologies variées telles que la stimulation électrique, la détection en temps réel de marqueurs physicochimiques, des matériaux adaptatifs aux morphologies des plaies et des systèmes de délivrance ciblée de médicaments. La combinaison de ces solutions pourrait transformer les pratiques cliniques, en offrant aux patients à la fois un suivi plus précis ainsi qu’un traitement personnalisé et efficace.
Ces efforts de recherche et d’investissement répondent à une prise de conscience croissante des défis posés par les plaies chroniques et à l’essor de ce marché de soins, qui a été évalué à 20,18 milliards de dollars en 2022 et pourrait atteindre 30,52 milliards d’ici 2030.
Marc Gozlan (Suivez-moi sur X, Facebook, LinkedIn, Mastodon, Bluesky)