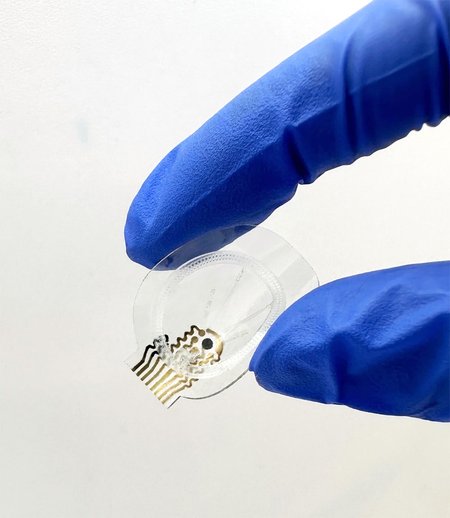
Une équipe du California Institute of Technology (CalTech, Pasadena) rapporte avoir développé un dispositif, porté sur le corps, permettant de surveiller en temps réel et de traiter une plaie chronique infectée. Ce système bioélectronique, communiquant sans fil, est ce que l’on appelle un « pansement intelligent ». Grâce à une série de capteurs, appelés biosenseurs, plusieurs paramètres dans la plaie chronique peuvent être mesurés.
Dans un article paru le 24 mars 2023 dans la revue en ligne Science Advances, les chercheurs californiens montrent que ce pansement intelligent bioélectronique a permis d’administrer dans la plaie un antibiotique et délivrer un courant électrique pour stimuler la régénération tissulaire. Ce traitement combiné a notablement accéléré la cicatrisation d’une plaie chronique chez des rats diabétiques.
Pied diabétique
Le pied diabétique est une appellation qui regroupe les infections et ulcérations des tissus du pied chez le patient vivant avec un diabète. Trois facteurs sont incriminés dans le développement des ulcères du pied diabétique : la neuropathie (atteinte des nerfs), l’artériopathie (atteinte des petits vaisseaux sanguins) et le taux de glucose dans le sang qui augmente le risque d’infection. La neuropathie périphérique entraîne une perte de sensibilité des pieds, une diminution de l’hydratation naturelle du pied engendrant sécheresse et fissures, des déformations osseuses du pied résultant en l’apparition de points de pression.
On estime que 15 % des patients diabétiques présenteront au cours de leur vie ce type de lésion du pied. Entre 50 % et 80 % de ces ulcères sont le siège d’infection. Il est admis que 10 % des diabétiques courent un risque d’amputation.
On parle de plaies chroniques lorsque le délai de cicatrisation est prolongé, en l’occurrence lorsque l’on n’observe pas de cicatrisation après quatre à six semaines malgré un traitement local. Aux États-Unis, environ 6,7 millions de personnes souffrent de plaies chroniques, également appelées plaies non cicatrisantes. Le coût de ces complications dépasse 25 milliards de dollars par an.
En France, environ 2 millions de personnes souffrent chaque année de plaies chroniques nécessitant entre 147 et 271 jours en moyenne pour cicatriser et un séjour hospitalier d’au moins deux mois.
Une infection sur une plaie peut grandement retarder le processus de cicatrisation, entraîner une nécrose (mort des tissus cutanés), un sepsis (état infectieux grave) et même la mort. Chaque année, on dénombre en France 51 000 décès associés à des complications infectieuses de plaies chroniques.
Les principaux traitements locaux sont le débridement chirurgical (retrait des tissus nécrotiques, dévitalisés et/ou infectés), l’application de pansements hydrocolloïdes pour créer un environnement chaud et humide favorable à la cicatrisation, la greffe de peau, la thérapie par pression négative qui aide à résorber l’excès de liquide dans la plaie (exsudat).
Quant au traitement général (systémique), il repose sur l’utilisation d’une antibiothérapie adaptée aux bactéries présentes au niveau de la plaie. L’administration d’antibiotiques par voie locale et générale chez les patients souffrant d’une plaie chronique non cicatrisante peut exposer, en cas de mésusage, de surdosage ou de mauvaise observance, au risque d’apparition d’une antibiorésistance.
Objectif : accélérer la cicatrisation grâce à des pansements intelligents
Pouvoir disposer de pansements intelligents, capables à la fois de surveiller le processus de cicatrisation et de l’accélérer, représente un objectif thérapeutique majeur en termes de traitement personnalisé des plaies chroniques. Un tel dispositif présente l’avantage de délivrer un traitement actif et personnalisé, avec intervention minimale du médecin.
Une plaie chronique comprend un exsudat, qui est un épanchement liquidien renfermant des protéines, des cellules (locales et ayant migré dans la lésion), et parfois des bactéries. La composition de l’exsudat change tout au long du processus de cicatrisation, ce qui renseigne sur son stade.
Des paramètres métaboliques et inflammatoires sous surveillance
Les biosenseurs permettent de quantifier certains paramètres au sein même de la plaie (in situ). Une augmentation de température est généralement associée à une infection bactérienne ou à une inflammation. Une élévation de l’acidité, estimée par la mesure du pH, est le signe d’une colonisation bactérienne, et donc de la survenue d’infection. Une hausse de la concentration en acide urique renseigne sur la sévérité de la plaie. Un taux élevé d’acide urique après infection est dû à l’augmentation de l’expression d’une enzyme en réponse à des molécules libérées lors du processus inflammatoire*.
Les taux de lactate et d’ammonium sont d’autres marqueurs de diagnostic d’une infection des tissus mous dans les ulcères des pieds chez les patients diabétiques. Enfin, la concentration du glucose dans l’exsudat est fortement corrélée à celle de la glycémie et de l’activité bactérienne. Tous ces paramètres sont importants pour décider de la prise en charge thérapeutique en cas de plaie chronique chez un patient diabétique.
D’autres paramètres peuvent être évalués in situ comme l’oxygénation (pO2), sachant qu’un manque d’oxygène (hypoxie chronique) retarde la prolifération cellulaire et augmente le risque d’infection.
Des biosenseurs peuvent également mesurer l’impédance, paramètre qui témoigne de la capacité d’un tissu à se laisser traverser par un signal électrique. Les valeurs de l’impédance renseignent sur l’état physiologique de la peau (niveau d’hydratation cutanée, viabilité cellulaire). La mesure de l’impédance permet ainsi de détecter précocement des escarres. En effet, contrairement aux plaies ouvertes, le stade initial des escarres (ulcères de pression) n’est pas visible. Ce type d’ulcération cutanée, associé à une ischémie (manque d’apport sanguin) et à des dommages tissulaires, entraîne une élévation de la conductivité électrique du fait de la libération d’ions contenus dans le cytoplasme des cellules mortes.
Biosenseurs pour une surveillance en temps réel
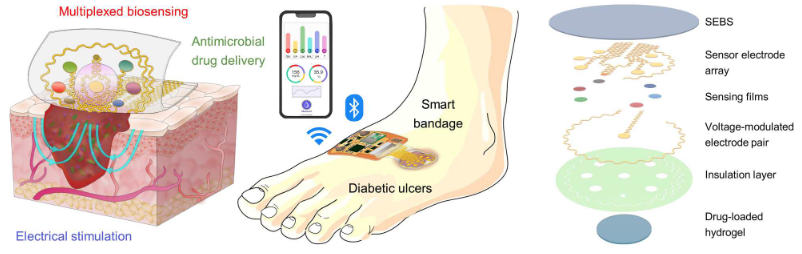
Les pansements intelligents reposent sur la bioélectronique, caractérisée par la convergence de systèmes biologiques et de l’électronique afin de traduire des signaux biologiques en signaux électriques. Ces dispositifs sont composés de biocapteurs (on parle de biosenseurs électrochimiques) pour surveiller en temps réel des indicateurs physiques et des biomarqueurs physiologiques au sein de la plaie.
La technologie est dite portable (on parle de wearable devices ou wearables, en anglais) pour désigner ces systèmes bioélectroniques, communiquant sans fil et adhérant à la peau.
Les progrès récents dans le domaine des wearables tiennent aux avancées réalisées dans le domaine des biomatériaux et de l’électronique flexible. Il importe en effet que ces pansements, qui adhèrent à la plaie durant la totalité du processus de cicatrisation, soient flexibles, étirables, perméables et biocompatibles. Par ailleurs, le pansement, censé préparer le lit de la plaie à la cicatrisation, doit le protéger de la colonisation bactérienne et de l’infection.
Il importe également que les divers composants du pansement ne soient pas altérés par l’exsudat de la plaie, ce qui affecterait les performances techniques des biosenseurs intégrés dans le pansement, et donc la fiabilité des mesures. Le pansement contient donc aussi une membrane poreuse externe afin de laisser « respirer » le pansement et ainsi protéger les électrodes.
Une « respirabilité » optimale de ce dispositif bioélectronique est donc essentielle pour permettre des échanges gazeux entre la plaie et le milieu extérieur et maintenir un certain degré d’humidité, essentiel au processus de cicatrisation. Une faible respirabilité entraînerait une accumulation de l’exsudat, alors qu’une respirabilité conduirait à une déshydratation de la plaie.
Évaluer la teneur de composants présents dans l’exsudat
Les chercheurs californiens ont développé un système bioélectronique, portable et étirable muni de biosenseurs mesurant en continu six biomarqueurs dans l’exsudat : la température, le pH, l’ammonium, le glucose, le lactate et l’acide urique. Cette surveillance multiplexée a été évaluée sur un temps prolongé, in vivo, chez des rongeurs diabétiques souffrant de plaie chronique. Les informations collectées par le pansement bioélectronique ont permis d’enregistrer les changements de composition du microenvironnement de la plaie ainsi que l’état inflammatoire d’une plaie infectée à différents stades de la cicatrisation.
Des électrodes servant à mesurer les différents biomarqueurs sont enchâssées dans un support élastique en élastomère thermoplastique (SEBS), hautement perméable, adhésif et biocompatible. Celui-ci, d’une épaisseur de 300 micromètres, renferme un réseau de microcircuits électroniques flexibles.
Fixé à la plaie cutanée à laquelle il adhère fortement, le pansement communique sans fil pour transmettre les informations sur les biomarqueurs. Les chercheurs ont enfin muni leur pansement, flexible et étirable, d’un gel poreux et conducteur (hydrogel électroactif, chargé négativement et fabriqué de façon précise par impression 3D).
Libération contrôlée d’un principe actif et stimulation électrique
Cet hydrogel renferme une molécule anti-inflammatoire et anti-microbienne et est équipé d’une paire d’électrodes qui permet à la fois la libération contrôlée de la molécule active (peptide anti-inflammatoire et antimicrobien) et la délivrance d’une stimulation électrique.
Sous l’effet d’une tension positive, l’hydrogel électroactif se contracte et expulse de l’eau, ce qui a pour conséquence de libérer de façon contrôlée la molécule anti-bactérienne qu’il renferme.
Un pansement flexible, biocompatible, étirable
La flexibilité et l’extensibilité de ce pansement bioélectronique sont essentielles pour assurer un bon contact avec la peau pendant la phase de cicatrisation de la plaie chronique, tout en résistant à quelques déformations mécaniques. Cela est d’autant plus important si la plaie siège en regard d’articulations, ce qui peut engendrer une déformation du pansement.
Les chercheurs ont vérifié que le pansement avait une bonne histocompatibilité et une bonne biocompatibilité in vitro. La viabilité et l’activité métabolique de cellules de peau humaine (fibroblastes, kératinocytes) n’ont pas été altérées lorsqu’elles ont été déposées sur une rangée de biosenseurs.
Électrostimulation
L’électrostimulation est reconnue comme une technique utile à la cicatrisation des plaies chroniques. Son intérêt tient au fait qu’il existe des courants endogènes dans la peau au cours du processus de cicatrisation. De fait, la stimulation électrique a un effet notable sur celui-ci, notamment via une stimulation de la prolifération de fibroblastes, la formation de collagène, la migration de kératinocytes, la formation de vaisseaux sanguins et l’attraction de macrophages (cellules immunitaires).
Les systèmes d’électrostimulation nécessitent cependant des consoles encombrantes et des câbles, ce qui complique leur utilisation en pratique clinique. Rien de tel si une stimulation électrique est délivrée par un pansement intelligent, portable, flexible, fonctionnant de façon autonome et communiquant sans fil.
De fait, les chercheurs californiens ont montré, dans un modèle in vitro, qu’une stimulation électrique de faible voltage délivrée par leur pansement entraîne une migration de fibroblastes dermiques plus rapide et plus importante dans la zone de la plaie qu’en l’absence de stimulation électrique. Cette meilleure régénération tissulaire est attribuée au champ électrique bidirectionnel induit par la paire d’électrodes. Celui-ci module le comportement des cellules, notamment leur migration vers la plaie. L’intégration dans le pansement d’un module de stimulation électrique pourrait donc accélérer la cicatrisation de la plaie en facilitant la mobilité et la prolifération cellulaire ainsi que le remodelage dans le processus de régénération tissulaire.
Le pansement a ensuite été évalué dans un modèle de plaie excisionnelle infectée (retrait de la totalité de l’épaisseur cutanée) chez des souris diabétiques. Le pansement a détecté une augmentation marquée de l’acide urique, de la température, du pH, du lactate et de l’ammonium par rapport à ce qui avait été observé avant l’infection. Les valeurs du pH, du lactate et de l’ammonium sont en rapport avec l’acidité du milieu, déjà rapportée en cas d’infection bactérienne.
À l’inverse, la concentration de glucose dans le liquide de la plaie a diminué de plus d’un tiers après infection, sans doute du fait de la consommation du glucose par les bactéries. Lors du traitement antibactérien, la température, le pH, les taux de lactate et d’ammonium sont revenus à leurs valeurs avant infection, tandis que le taux de glucose est remonté significativement.
Il apparaît donc que ce pansement bioélectronique permet d’analyser des paramètres métaboliques en continu du milieu liquide présent dans une plaie chronique.
Un pansement intelligent, muni de sept biosenseurs de pH et neuf carotteurs de température, a également été évalué sur de plaies larges (3,5 cm de diamètre) et profondes (en pleine épaisseur cutanée) chez des rats diabétiques. Les résultats ont été similaires à ceux obtenus précédemment chez les souris diabétiques, en même temps que de grandes variations de pH et de température ont été observées après infection dans différents endroits de la zone lésée, avec une plus forte croissance bactérienne sur les berges de la plaie.
Accélération de la cicatrisation dans un modèle animal
L’effet thérapeutique du pansement bioélectronique a été évalué in vivo dans un modèle de plaie excisionnelle chez des rats diabétiques. Quatre groupes de rongeurs ont été analysés : un groupe contrôle, un groupe bénéficiant d’une libération d’une molécule anti-bactérienne, un autre d’une stimulation électrique seule, et le dernier d’un traitement combiné (stimulation électrique et libération de l’antibiotique).
La charge bactérienne dans le lit de la plaie était significativement moindre après trois jours de traitement combiné, par rapport à la seule stimulation électrique et à aucune intervention (groupe contrôle). La fermeture de la plaie a été plus fréquemment observée chez les rats ayant bénéficié du traitement combiné que chez les autres. Les chercheurs ont collecté des données provenant des pansements intelligents de façon continue durant 8 jours, jusqu’à assèchement de la plaie suite au traitement. Alors que chez les animaux contrôles la cicatrisation a entraîné une cicatrice significativement surélevée, rien de tel n’a été observé chez les rats ayant reçu un traitement combiné, témoignant d’une réparation uniforme du derme.
Enfin, les chercheurs ont montré par analyse PCR quantitative que le traitement combiné des plaies des animaux s’est accompagné d’une expression accrue de gènes codant des facteurs de croissance et impliqués dans le processus de cicatrisation.
L’ensemble de ces résultats, obtenus dans des plusieurs modèles animaux, confirme que le pansement bioélectronique accélère la cicatrisation de plaies chroniques.
Ehsan Shirzaei Sani, Wei Gao et leurs collègues de la division d’ingénierie et sciences appliquées de Caltech estiment que leur pansement intelligent est aisément reconfigurable pour surveiller d’autres biomarqueurs métaboliques et inflammatoires dans d’autres types de plaies chroniques.
De nombreux travaux restent à conduire avant de disposer chez l’homme de ces pansements intelligents dans le traitement des plaies chroniques, capables de fonctionner sur de longues durées. Il importera également de s’assurer que ces pansements pourront être fabriqués à grande échelle.

En novembre 2002, une équipe de l’université de Stanford (Californie) a rapporté dans la revue Nature Biotechnology des résultats prometteurs avec un autre type de pansement intelligent, dont les données étaient transmises sans fil sur un smartphone.
Les composants de ce système reposent sur un hydrogel adhésif, élastique et conducteur. Ce pansement intelligent comprend un circuit électronique miniaturisé et flexible, d’environ 100 micromètres d’épaisseur, une antenne qui produit l’énergie nécessaire à la stimulation électrique délivrée par des électrodes, et des biosenseurs qui transmettent les données d’impédance et de température via un transpondeur NFC dans le microcontrôleur. Ce système bioélectronique fonctionne de façon autonome, autrement dit en boucle fermée.
Ce pansement souple et flexible peut être retiré facilement sans créer de dommages secondaires au délicat tissu cutané sous-jacent. Il est biocompatible, n’ayant causé ni allergie, ni irritation, chez les souris traitées qui n’étaient pas gênées pour se déplacer dans leur cage.
Ce dispositif, intégrant des biosenseurs et un système de stimulation électrique, s’est montré capable, chez la souris, de surveiller le processus de cicatrisation et d’accélérer la réparation de la plaie (notamment en augmentation la formation de nouveaux vaisseaux sanguins dans les plaies stimulées).
Chez des souris diabétiques, ce pansement a permis de surveiller en continu l’impédance et la température d’un modèle de plaie excisionnelle et de délivrer une stimulation électrique programmée en réponse au micro-environnement de la lésion. Par rapport aux souris du groupe contrôle, le groupe des souris traitées a cicatrisé environ 25 % plus rapidement, avec une amélioration d’environ 50 % du remodelage dermique par rapport au groupe témoin. Chez les souris traitées, ce pansement a également permis de réduire significativement le risque d’infection, en diminuant le taux global de bactéries dans la plaie.
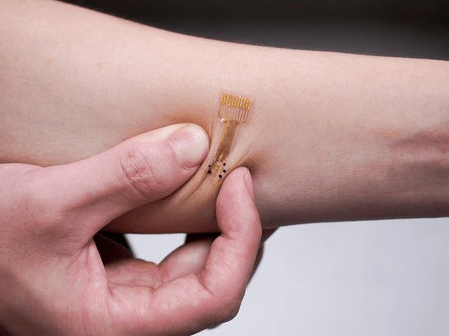
Les prochaines études sur des prototypes de pansements intelligents devraient être menées chez le porc, du fait des ressemblances anatomiques, physiologiques et fonctionnelles chez cet animal avec le processus de cicatrisation chez l’homme.
Il s’agira également d’évaluer, sur de la peau humaine, des pansements de plus grande taille et de différentes formes que ceux testés chez des rongeurs. Un autre objectif sera de parvenir à réduire les coûts de fabrication de ces dispositifs hypersophistiqués. Leur efficacité clinique devrait par ailleurs être évaluée dans d’autres pathologies cutanées que celles associées au diabète. Les prototypes actuels pourraient donc ouvrir la voie à une nouvelle génération de pansements intelligents, fonctionnant sans fil et en boucle fermée.
Enfin, l’intégration des données recueillies par ces dispositifs bioélectroniques à un système d’intelligence artificielle peut potentiellement permettre l’identification de plaies aux profils métaboliques particuliers, et éventuellement accélérer la prise de décision thérapeutique en choisissant d’individualiser le traitement administré par l’intermédiaire de ces pansements.
Marc GOZLAN (Suivez-moi sur Twitter, Facebook, LinkedIn, Mastodon)
* Les taux élevés d’acide urique sont dus à la surexpression de la xanthine oxydase, enzyme du système immunitaire impliquée dans le métabolisme des purines, en réponse aux cytokines inflammatoires dans les ulcères chroniques.