Baptisé « pancréas bionique », un dispositif expérimental capable d’administrer automatiquement de l’insuline s’est avéré plus efficace pour maintenir la glycémie dans des valeurs cibles normales que le traitement insulinique standard chez les personnes atteintes de diabète de type 1, rapporte une étude publiée le 29 septembre 2022 dans le New England Journal of Medicine.
Cet essai clinique américain, multicentrique et randomisé, a été conduit dans 16 centres sur une période de 13 semaines. Mené sous l’égide du Bionic Pancreas Research Group, il a été principalement financé par le National Institute of Diabetes and Digestive and Kidney Diseases (NIDDK).
Plusieurs technologies ont été récemment développées afin de faciliter la prise en charge thérapeutique du diabète. Certains dispositifs permettent la mesure en continu du glucose dans le liquide interstitiel (dans lequel « baignent » nos cellules), tandis que d’autres consistent à calibrer précisément les multiples doses quotidiennes d’insuline délivrées en perfusion sous-cutanée par l’intermédiaire de pompes à insuline. D’autres dispositifs reposent sur le concept dit en « boucle fermée » dans lequel l’insulinothérapie est automatiquement régulée par le niveau de la glycémie, ce qui constitue une approche plus physiologique du traitement du diabète. Les algorithmes utilisés sont conçus sur le principe du rétrocontrôle, la dose d’insuline administrée tenant compte de l’écart de la glycémie évaluée à chaque instant et la valeur cible visée, ainsi que de la variation de la glycémie sur de courts intervalles. La délivrance d’insuline par ce type de dispositif peut être interrompue de façon à éviter la survenue d’épisodes hypoglycémiques. À l’inverse, il est possible de délivrer des doses supplémentaires pour atténuer les effets d’une hyperglycémie. Un des grands avantages de ces systèmes d’administration automatique d’insuline est la réduction considérable des hypoglycémies nocturnes.
Bien que le but ultime de ces systèmes de haute technologie soit une automatisation complète de l’administration d’analogues d’insuline d’action rapide, la participation du patient est le plus souvent requise. De fait, c’est une approche hybride qui est utilisée, le patient devant renseigner le système, avant le repas, sur le contenu glucidique de sa prochaine prise alimentaire. Ceci afin d’anticiper l’adaptation nécessaire de la perfusion d’insuline en vue de maîtriser l’augmentation attendue de la glycémie post-prandiale. Une période d’apprentissage (warm-up period) est nécessaire. En effet, le système doit engranger suffisamment de données sur les doses d’insuline contrôlées de la part du patient utilisateur pour être ensuite opérationnel. Cinq de ces systèmes ont reçu le marquage CE.
Mais revenons à l’essai clinique dirigé par Steven Russell et ses collègues du centre de recherche sur le diabète du Massachusetts General Hospital de Boston. Ces investigateurs cliniciens ont utilisé un tout autre dispositif : le pancréas bionique (iLet Bionic pancreas de la firme Beta Bionics).
Le pancréas bionique iLet est un système d’administration automatisée d’insuline, non encore homologué par la Food and Drug Administration (FDA). Il se compose d’une pompe à insuline de la taille d’une carte de crédit, qui reçoit un signal provenant d’un système de mesure du glucose en continu dans le liquide interstitiel, et d’un smartphone (ou d’un lecteur connecté). Il utilise des algorithmes mathématiques autonomes qui calculent les doses d’insuline délivrées automatiquement via un dispositif de perfusion de l’insuline, consistant en un fin cathéter en Téflon implanté en angle droit par rapport à la peau de l’abdomen.
Entrer seulement le poids du patient pour initialiser l’algorithme
Ce système de haute technologie n’utilise pas d’informations relatives aux précédentes administrations d’insuline (insuline basale, doses des bolus). Il ne repose que sur le poids du patient, paramètre qui suffit à initialiser les algorithmes. Le système détermine ensuite automatiquement toutes les doses d’insuline.
Aucune warm-up period n’est nécessaire. Le patient n’a plus l’obligation de fournir au système une estimation quantitative de sa ration en glucides avant chaque repas. Une simple estimation qualitative suffit : il n’a qu’à simplement dire s’il s’agit d’un petit-déjeuner, d’un déjeuner ou d’un diner « habituel pour lui » (usual for me), plus copieux que d’ordinaire (more) ou moins riche que d’habitude (less). Les algorithmes embarqués font le reste. Après que le patient a renseigné le système sur son type de repas, le dispositif est réglé pour délivrer automatiquement et immédiatement 75 % de la dose d’insuline prévue.
Le système a été paramétré par défaut de telle façon que la valeur cible de la glycémie habituelle soit de 120 mg/dL (6,7 mmol/L), avec des fluctuations à la hausse ou à la baisse de 10 mg/dL (0,6 mol/L), de telles variations pouvant être tolérées pendant une partie de la journée. Les algorithmes se chargent de déterminer les doses thérapeutiques d’insuline (insuline basale, corrections des doses et des bolus, doses délivrées après l’annonce des repas). Il est impossible pour le patient de déterminer ou de modifier les doses d’insuline administrées. En effet, il n’existe pas de mécanisme permettant à l’utilisateur de modifier manuellement l’administration d’insuline.
L’interface utilisateur affiche les valeurs en continu de glucose et les doses d’insuline. Elle permet également au patient d’indiquer la taille et la nature du repas.
Le modèle de pancréas bionique utilisé dans cet essai clinique a été développé pour servir aussi bien de système de perfusion d’insuline seule que de système bi-hormonal, capable de délivrer à la fois de l’insuline et du glucagon (deux hormones normalement sécrétées par le pancréas, le glucagon possédant une fonction hyperglycémiante, opposée à celle de l’insuline).
Conduit entre janvier et juillet 2021, l’essai clinique a consisté à évaluer l’efficacité et la sécurité d’emploi du pancréas bionique dans la configuration insuline seule auprès d’adultes et d’enfants (de 6 ans et plus) vivant avec un diabète de type 1.
L’administration d’insuline via le pancréas bionique a été comparée au traitement insulinique standard, celui-ci consistant en n’importe quelle méthode d’administration d’insuline associée à une mesure continue du glucose (MCG). Les participants inclus dans le groupe traitement standard ont continué à utiliser leur mode d’administration habituel (injections quotidiennes d’insuline, une pompe à insuline non automatique ou automatisée, un système à boucle fermée) et se sont vus remettre un système de surveillance du glucose en continu (Dexcom G6). Au total, 326 patients (âgés de 6 à 79 ans) ont participé à cet essai clinique : 219 dans le groupe utilisant le pancréas bionique, 107 dans le groupe traitement standard. Parmi ces derniers, 30 % utilisaient un système hybride à boucle fermée.
L’essai avait pour objectif principal de déterminer à la 13e semaine le taux d’hémoglobine glyquée (reflet de la glycémie). Les critères secondaires de jugement consistaient à évaluer le pourcentage du temps durant lequel la glycémie (mesurée par le système de surveillance du glucose en continu) restait en-deçà de 54 mg/dL (3 mmol/L). Deux autres critères de jugement de l’essai ont été évalués : le taux moyen de la glycémie et le pourcentage de temps durant lequel la glycémie était comprise entre 70 et 180 mg/dL (3,9 à 10 mmol/L), ce que l’on appelle le « temps passé dans la cible ».
Les investigateurs ont enregistré un nombre moins important d’épisodes prolongés d’hyperglycémies (> 180 mg/dL ou > 250 mg/dL) avec le pancréas bionique qu’avec le traitement standard.
La sécurité d’emploi du pancréas bionique a été évaluée à partir de l’incfcidence des épisodes d’hypoglycémie sévère et l’éventuelle survenue de graves complications (notamment d’une acidocétose diabétique). L’effet secondaire indésirable le plus souvent rapporté dans le groupe pancréas bionique a été la survenue d’une hyperglycémie, le plus souvent attribuée à un défaut du système de perfusion de l’insuline par le cathéter en Téflon.
Un taux d’hémoglobine glyquée inférieur dans le groupe pancréas bionique en fin d’essai
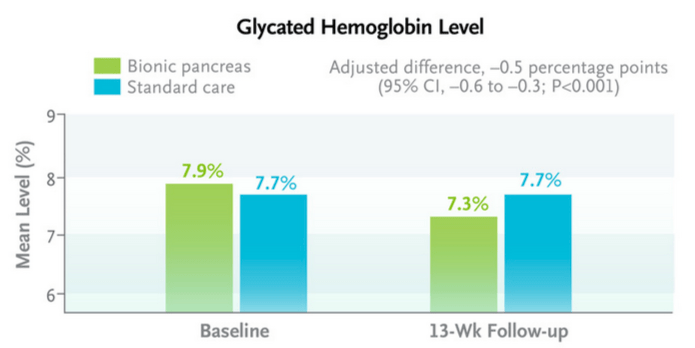
Les résultats montrent que le taux moyen d’hémoglobine glyquée (HbA1c) à 13 semaines, qui était de 7,9 % au début de l’essai, a diminué à 7,3 % dans le groupe pancréas bionique mais n’a pas varié dans le groupe traitement standard. La différence du taux moyen d’hémoglobine glyquée était similaire dans la cohorte des patients adultes et dans la cohorte pédiatrique. Par ailleurs, l’impact du traitement par le pancréas bionique sur le taux d’hémoglobine glyquée a été plus important chez les participants dont le taux d’HbA1c était élevé en début d’essai.
Concernant les critères secondaires de jugement, il ressort que le pourcentage du temps passé avec une glycémie inférieure à 54 mg/dL était similaire dans le groupe des patients utilisant le pancréas bionique et dans le groupe de ceux continuant à suivre leur traitement insulinique standard (respectivement 0,2 % et 0,3 % à la 13e semaine). Aucune différence significative sur ce paramètre n’a été observée entre les deux groupes.
À la 13e semaine, le taux moyen de la glycémie (évaluée par la MCG) a été inférieur de 16 mg/dL (0,9 mmol/L) dans le groupe pancréas bionique par rapport à celui observé dans le groupe traitement standard.
Plus de deux heures et demie supplémentaires par jour de temps passé dans la cible
Il apparaît que la différence entre les deux groupes concernant le pourcentage de temps durant lequel la glycémie se situait entre 70 et 180 mg/dL a été de 11 %, ce qui représente une durée de 2,6 heures par jour en faveur du groupe pancréas bionique. En outre, le temps durant lequel la glycémie a pu dépasser 180 mg/dL (ou 250 mg/dL) a été moins long dans le groupe pancréas bionique que dans celui des patients suivant leur traitement habituel.
Deux épisodes d’hypoglycémie sévère ont été enregistrés dans le groupe pancréas bionique, trois dans le groupe traitement standard. Aucun cas d’acidocétose diabétique n’a été observé.
Dans un éditorial associé à l’article, Jennifer Sherr, pédiatre spécialisée en endocrinologie de la faculté de médecine de Yale (New Haven, Connecticut), déclare que « ce qui rend ces résultats extrêmement importants, c’est que les critères requis pour l’utilisation de ce mode d’administration de l’insuline tiennent en une seule chose : avoir un diabète de type 1 ». Et d’ajouter : « ces résultats peuvent être plus facilement généralisés à l’application de la technologie dans le monde réel lorsque l’approbation réglementaire sera obtenue. En effet, on peut supposer qu’une grande partie des calculs qui pèsent sur le patient [obligé d’estimer la ration glucidique de chaque repas] dans la gestion du diabète soit allégée avec le pancréas bionique ». Selon cette spécialiste du diabète de type 1, malgré le fait que les médecins aient à cœur de proposer aux patients les meilleurs outils d’administration de l’insuline, force est de constater que la complexité des systèmes aujourd’hui disponibles entravent fréquemment leur utilisation. À l’inverse, « le pancréas bionique atteste de la faisabilité d’une technologie simplifiée, qui permet de surmonter ce problème ».
Et Jennifer Sherr de conclure que, même si les résultats obtenus aujourd’hui en termes de réduction du taux d’hémoglobine glyquée grâce aux capteurs de la glycémie en continu sont impressionnants et que, sans aucun doute, l’administration automatisée d’insuline sera encore plus performante à l’avenir, « un système avec une délivrance automatisée et simplifiée d’insuline, tel que le pancréas bionique, pourrait être la solution ».