Dans le diabète, une approche thérapeutique séduisante consiste à emprisonner des cellules pancréatiques dans un dispositif implanté sous la peau afin qu’elles produisent de l’insuline directement utilisable par l’organisme. Les spécialistes parlent de thérapie cellulaire par macro-encapsulation pour désigner l’incorporation d’une masse importante d’îlots pancréatiques sécréteurs d’insuline dans un dispositif implantable.
Le diabète de type 1 résulte de la destruction des cellules bêta productrices d’insuline localisées au sein des îlots de Langerhans du pancréas. Malgré l’injection pluriquotidienne d’insuline, certains patients ne parviennent pas à contrôler leur glycémie. La thérapie cellulaire du diabète de type 1 consiste à remplacer les cellules bêta pancréatiques détruites par des cellules insulino-sécrétrices emprisonnées dans un implant placé sous la peau, ce qui permet une régulation de la glycémie plus physiologique. En effet, le contrôle de la glycémie par les injections d’insuline ne peut égaler celui qu’exercent chez un individu sain les cellules des îlots pancréatiques en réponse aux variations du taux de glucose sanguin.
L’objectif d’un dispositif médical « vivant » implantable est donc de transplanter des cellules produisant de l’insuline afin que cette hormone diffuse à travers une membrane semi-perméable pour sortir de l’implant, rejoigne les vaisseaux sanguins et exerce son action dans l’organisme.
Le but ultime de la macro-encapsulation d’îlots pancréatiques est de réduire les besoins en insuline des patients traités, voire de permettre à certains de se passer des injections d’insuline qui compliquent leur quotidien.
Classiquement, la transplantation de cellules bêta repose sur la greffe d’îlots issus de cadavres, les îlots purifiés à partir de pancréas de ces donneurs étant transplantés dans le foie via une injection dans la veine porte. Ce type de transplantation d’îlots permet d’améliorer le contrôle de la glycémie, avec une amélioration considérable de la qualité de vie, que le patient soit ou non sevré d’insulinothérapie exogène. Ce succès tient aux progrès réalisés à la fois en matière d’immunosuppression et à la quantité d’îlots pouvant être transplantés. Pratiquée dans de nombreux centres dans le monde, dont la France, la greffe d’îlots de Langerhans nécessite deux à trois pancréas. Or, on manque de donneurs.
Dans le cadre de dispositifs sous-cutanés de macro-encapsulation, la thérapie cellulaire repose sur la transplantation d’îlots pancréatiques ou de cellules sécrétrices d’insuline issues de cellules souches pluripotentes amenées à se différencier en laboratoire en cellules bêta-pancréatiques, ou encore de cellules manipulées génétiquement pour produire de l’insuline. Plusieurs sociétés de biotechnologies et équipes de recherche ont développé des dispositifs reposant sur la transplantation de cellules productrices d’insuline générées in vitro.
Le défi majeur de l’oxygénation des cellules pancréatiques transplantées
Dès lors que l’on envisage d’utiliser des cellules transplantées encapsulées, on se heurte à un problème majeur : leur oxygénation. En effet, ces précieuses cellules ont besoin d’oxygène pour survivre. Il a été montré qu’un faible apport en oxygène entraîne l’échec de la transplantation cellulaire. Par ailleurs, l’organisme peut réagir à la présence du dispositif en induisant la formation d’un tissu fibreux cicatriciel autour de ce qu’il considère comme un corps étranger. En isolant un peu plus les cellules transplantées des vaisseaux sanguins environnants, ce tissu fibreux peut accentuer le manque d’oxygénation (ou hypoxie), limiter l’apport en nutriments et en glucose et réduire la diffusion de l’insuline entre les cellules transplantées et l’hôte.
L’oxygénation des cellules transplantées est un enjeu crucial dans la mesure où les cellules qui produisent l’insuline sont très actives sur le plan métabolique. Alors qu’elles représentent à peine 1% de la masse totale du pancréas, elles utilisent entre 10 % et 15 % de l’approvisionnement sanguin artériel de cet organe et consomment entre 5 % et 20 % d’oxygène parvenant au pancréas. Dans cet organe, les îlots, qui sont des structures sphériques, se situent à proximité immédiate de vaisseaux artériels qui les alimentent en oxygène, à une distance n’excédant pas les 200 micromètres.
Il importe donc de lutter contre le manque d’oxygénation (hypoxie) dans les jours qui suivent la transplantation. On observe ainsi un taux significatif de mortalité cellulaire lorsque l’on cultive ces cellules en conditions hypoxiques (dans un milieu avec une faible teneur en oxygène, 1 % d’O2). En revanche, il a été observé une viabilité cellulaire d’environ 90 % lorsque des îlots pancréatiques, contenus par le dispositif oxygénateur, étaient soumis aux mêmes conditions (pO2 = 1 %), soit un résultat proche de la viabilité observée (100 %) dans des conditions normoxiques (dans lesquelles l’oxygène est en concentration normale).
Plusieurs stratégies ont récemment été développées pour augmenter l’oxygénation des cellules productrices d’insuline contenues dans des dispositifs implantables.
L’une d’elles consiste, par l’intermédiaire d’un fin cathéter relié au dispositif, à délivrer de l’oxygène dans le réservoir contenant les précieuses cellules. En plus d’être encombrant, un tel système oblige à une alimentation régulière. Il n’est donc ni simple, ni satisfaisant, en pratique clinique.
Une alternative consiste à développer des implants qui contiennent une quantité limitée de réactifs capables de générer de l’oxygène. Du peroxyde de calcium peut ainsi être incorporé dans le dispositif. Ce composé est en effet capable de libérer de l’oxygène et de l’eau après activation par électrolyse. D’autres dispositifs utilisent du peroxyde de lithium pour produire de l’oxygène à partir du dioxyde de carbone excrété par les îlots.
Aucune de ces stratégies ne s’est cependant révélée satisfaisante à long terme lors d’expériences menées in vivo chez l’animal.
Production d’oxygène par électrolyse de la vapeur d’eau
Des chercheurs du Massachusetts Institute of Technology (MIT, Cambridge) rapportent dans les Comptes rendus de l’Académie américaine des sciences (Proceedings of the National Academy of Sciences, PNAS) avoir développé un dispositif implantable, sans fil traversant la peau, sans batterie, capable de produire l’oxygène dont les cellules transplantées ont besoin pour survivre. Comment ? En utilisant une ressource illimitée dans le corps : la vapeur d’eau qui, par électrolyse, produit de l’oxygène. Ce procédé de conversion électrochimique de l’eau en oxygène (O2) et hydrogène (H2) nécessite l’application d’un courant électrique.
Un système d’électrolyse de l’eau à membrane échangeuse de protons
La production d’oxygène repose sur le transport de la vapeur d’eau à travers la membrane échangeuse de protons (PEM, pour proton exchange membrane), au niveau de laquelle se produit la décomposition de l’eau en oxygène et hydrogène.
L’oxygène produit est stocké dans une chambre de diffusion en silicone. Celle-ci est directement reliée à l’anode et est séparée du compartiment hébergeant les cellules par une membrane perméable à l’oxygène. De forme rectangulaire, cette membrane polymère joue un rôle important car elle permet l’oxygénation continue des cellules et évite que ces celles-ci soient directement en contact avec l’électronique embarquée. Quant à l’hydrogène produit à la cathode, il se dissipe localement, sans poser de problème.
Le système d’électrolyse de la vapeur d’eau à membrane échangeuse de protons est ici essentiel dans la mesure où il évite d’alimenter le dispositif avec des fluides, de manipuler des liquides et d’apporter régulièrement de l’oxygène dans la chambre où se trouvent les cellules productrices d’insuline.
L’interface entre la chambre contenant les cellules et les tissus environnants est délimitée par une autre membrane poreuse ayant pour fonction d’isoler le dispositif « vivant » du système immunitaire de l’hôte. En effet, les pores, qui sont d’une taille d’environ 400 nanomètres, ne laissent pas passer les cellules immunitaires et les anticorps. En revanche, la membrane permet le passage de molécules essentielles, telles que l’oxygène, des nutriments et bien sûr l’insuline qui parviendra ensuite dans la circulation sanguine.
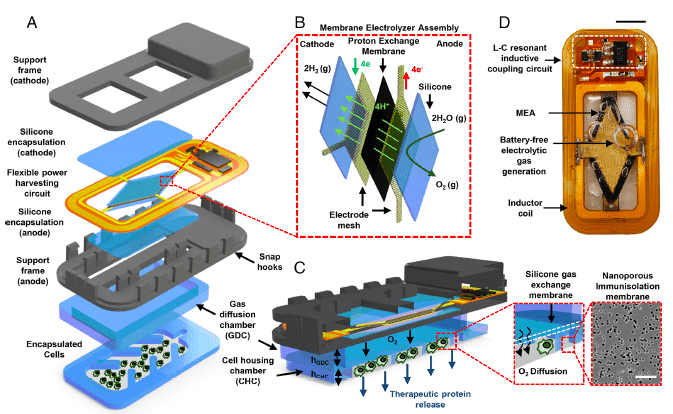
Le dispositif comprend donc divers compartiments, emboîtés les uns aux autres, et fabriqué avec des matériaux biocompatibles. Il permet d’encapsuler des cellules et de les isoler du système immunitaire de l’hôte, de capter de l’énergie sans fil, de produire de l’oxygène par électrolyse, de stocker ce gaz et le délivrer aux cellules transplantées insilino-sécrétrices, et d’assurer la diffusion de l’insuline ainsi produite.
Un dispositif immunoprotecteur
Ce dispositif multi-compartiments a par ailleurs été conçu pour permettre une oxygénation directe des cellules transplantées, tout en les isolant du système immunitaire de l’hôte. Il doit en effet protéger les cellules productrices d’insuline d’une attaque par le système immunitaire de l’hôte. Ce dispositif immunoprotecteur évite d’avoir recours à un traitement immunosuppresseur.
Pouvoir se passer d’immunosuppression, tout en utilisant des cellules allogéniques (ne provenant pas du patient, mais d’un donneur) serait un grand progrès dans la mesure où un traitement immunosuppresseur à vie est associé à un risque accru d’infection, de cancer, mais également d’atteintes sur divers organes (dont les cellules des îlots) et de troubles métaboliques.
Transmission d’énergie par couplage inductif par résonance
L’alimentation en énergie d’un tel dispositif médical est l’un des aspects le plus déterminant. Ici, l’énergie est transmise par une bobine extérieure qui l’envoie à une bobine intégrée au dispositif. La technologie en question est appelée transmission d’énergie par couplage inductif par résonance.
Ce dispositif, fin et entièrement flexible, ne comprend pas de batterie. Dans le cas contraire, cela nécessiterait de la recharger et augmenterait le poids et la taille de l’ensemble. Dans un tel cas, il faudrait également s’assurer qu’il n’y ait aucune fuite de matériaux potentiellement toxiques. La transmission d’énergie par couplage inductif par résonance ne comporte pas non plus de fil pénétrant la peau, ce qui écarte le risque d’infection cutanée.
Le système comprend un transmetteur externe et un receveur interne, à savoir une antenne flexible. Il a été conçu pour fonctionner à une fréquence de résonance de 13,56 Hz. Le transmetteur externe est composé d’une bobine magnétique, dont les chercheurs espèrent à l’avenir qu’elle pourrait être portée sous la forme d’un patch sur la peau du patient. Il a été montré que cet implant permet d’augmenter rapidement la pression partielle d’oxygène dans la chambre de diffusion. Celle-ci passe de 20 % (air ambiant) à 45 % en 80 minutes. Lors de la production de l’oxygène, la température de l’implant augmente de moins de 1,5 °C.
Transplantation d’îlots pancréatiques de rat à des souris diabétiques
Daniel Anderson et ses collègues du MIT rapportent dans un article paru le 3 octobre 2023 dans les PNAS les résultats de l’utilisation de ce dispositif implantable chez des souris rendues diabétiques. Les cellules transplantées étaient des cellules d’îlots pancréatiques de rat, c’est-à-dire d’une autre espèce de rongeur (xénotransplantation). Les chercheurs ont étudié le fonctionnement de ce dispositif de délivrance d’insuline pendant une durée d’un mois et en l’absence d’administration d’un traitement immunosuppresseur aux souris.
Dans une approche à visée curative, il faudrait transplanter chez l’homme un nombre de cellules pancréatiques correspondant à environ la masse de 350 000 îlots. On comprend aisément que transplanter un tel volume sans résoudre la question de leur oxygénation est illusoire.
Le dispositif conçu par les chercheurs du MIT devrait permettre d’atteindre une densité équivalente à 5 000 îlots pancréatiques par cm2, ce qui représente en soi un progrès notable par rapport aux dispositifs de macro-encapsulation actuels. Des essais cliniques chez l’homme devraient prochainement évaluer les performances, en termes de survie et de capacité fonctionnelle, d’un implant de plusieurs centimètres carrés ayant la taille d’une tablette de chewing-gum.
Les chercheurs ont montré que les cellules cultivées dans leur dispositif sécrètent, à J4 et J7 post-transplantation, significativement plus d’insuline en réponse à la présence de glucose que des îlots transplantés ne disposant pas d’une supplémentation en oxygène.
Maintien d’une glycémie normale chez des souris diabétiques pendant plus d’un mois
Surtout, il a été montré que ce dispositif, hébergeant des îlots pancréatiques de rat, a permis de normaliser pendant plus d’un mois la glycémie de souris diabétiques. Leur taux de glucose sanguin est revenu à la normale le lendemain de la mise en place de l’implant. Dans le groupe de souris témoins, ayant reçu un nombre identique d’îlots pancréatiques mais avec un dispositif non doté d’une production d’oxygène, la glycémie a baissé jusqu’à J5 avant de remonter à J12 aux valeurs observées avant la transplantation. Dans le groupe contrôle, la glycémie n’est jamais descendue à une valeur normale.
Globalement, dans le groupe de souris bénéficiant du dispositif générateur d’oxygène, les chercheurs ont enregistré chez les animaux des taux de glycémie significativement inférieurs et un meilleur contrôle de la glycémie (173 ± 12 mg/dL), contrairement à ce qui a été observé chez les souris contrôles greffées avec des îlots non oxygénés (444 ± 23 mg/dL). Par ailleurs, le retrait de l’implant a entraîné deux jours plus tard le retour de l’hyperglycémie à des valeurs semblables à celles d’avant la transplantation.
L’expérience a été réalisée ensuite sur un plus grand nombre de souris. Six des neuf souris du groupe ayant reçu le dispositif avaient une glycémie normale à la fin de l’étude. En revanche, aucun des cinq animaux contrôles n’avait atteint une normoglycémie au bout de quinze jours. Sur les trois les échecs observés dans le groupe de souris ayant reçu le dispositif oxygénateur, un était imputable à la migration sous la peau du dispositif, avec pour conséquence un manque d’énergie transmise. Une panne électronique explique les deux autres échecs. Les dispositifs ont été bien tolérés, avec une bonne cicatrisation après implantation sous-cutanée.
Les dosages en protéine sérique glyquée (équivalent de l’hémoglobine glyquée chez l’homme) ont montré, chez les souris ayant reçu le dispositif, des valeurs inférieures à celles obtenues chez le groupe contrôle non oxygéné. De même, après injection d’une dose de charge en glucose, la glycémie est revenue aux valeurs de base après 30 minutes chez les souris dotées du dispositif, alors que celles du groupe contrôle présentaient une hyperglycémie persistante après 2 heures.
Enfin, les dosages sériques de l’insuline avant et après perfusion intrapéritonéale de glucose aux rongeurs ont permis de montrer que le dispositif était capable de réguler la sécrétion d’insuline en réponse aux changements de la glycémie. Les chercheurs n’ont pas observé la formation de tissu fibreux cicatriciel autour de leur dispositif, ce qui aurait pu réduire son efficacité en s’opposant à la délivrance de l’insuline.
Preuve de concept in vivo
En résumé, les chercheurs du MIT ont réussi à protéger les cellules productrices d’insuline d’une destruction par le système immunitaire de l’hôte, tout en permettant d’améliorer leur oxygénation. Ils sont parvenus à obtenir une normalisation de la glycémie chez des souris diabétiques grâce à un dispositif bioélectronique assurant l’oxygénation de cellules pancréatiques provenant d’une autre espèce de rongeur. Preuve que ce système est opérationnel et capable de protéger les cellules transplantées vis-à-vis du système immunitaire de l’hôte.
Le développement de tels dispositifs implantables visant à traiter le diabète de type 1 par transplantation de cellules insulino-sécrétrices dépend d’une collaboration multidisciplinaire entre spécialistes en génie biomédical (notamment en bioélectronique et matériaux), biologistes cellulaires et diabétologues. Plusieurs sociétés industrielles et laboratoires de recherche sont en compétition pour commercialiser des dispositifs médicaux sophistiqués embarquant une masse suffisante de cellules bêta.
Les résultats présentés par les chercheurs américains constituent une preuve de concept in vivo d’une thérapie cellulaire du diabète de type 1 par transplantation de cellules macro-encapsulées. Celle-ci pourrait trouver des applications thérapeutiques dans d’autres pathologies que le diabète. Cette même équipe a d’ailleurs évalué avec succès chez la souris un dispositif contenant des cellules génétiquement modifiées pour produire de l’érythropoïétine (EPO), hormone qui stimule la production des globules rouges.
D’autres applications peuvent également être envisagées, comme la délivrance d’une substance d’intérêt thérapeutique dans la maladie de Parkinson ou encore la diffusion d’un médicament à la demande dans des pathologies hématologiques ou cancéreuses.
Des essais cliniques visant à traiter le diabète de type 1 par transplantation de cellules insulino-sécrétrices macro-encapsulées vont prochainement débuter, de même que des essais de traitement par transplantation de cellules insulino-sécrétrices générées à partir de cellules souches pluripotentes. Cette dernière alternative permettrait de disposer d’une source illimitée de cellules produisant de l’insuline. On peut raisonnablement espérer pouvoir disposer dans un avenir relativement proche (dans une décennie) d’une thérapie cellulaire du diabète, sûre et efficace, pour de nombreux patients.
Marc Gozlan (Suivez-moi sur Twitter, Facebook, LinkedIn, Mastodon)