C’est l’histoire d’un patient vivant avec un diabète non insulino-dépendant, bien contrôlé, avec insuffisance rénale modérée, qui a développé une infection fongique, très rapidement évolutive. Ce patient sexagénaire a présenté une mucormycose, une affection qui reste sévère chez le patient diabétique et qu’il importe d’évoquer malgré sa rareté dans la mesure où le pronostic vital dépend de la précocité de la prise en charge médicale et chirurgicale. Tout a commencé chez cet homme de 67 ans par une infection des voies respiratoires supérieures avec des symptômes de sinusite. Ce patient, ne souffrant pas de déficit immunitaire, présente un cortège de signes généraux : malaise, toux productive, mal de dos, nausées, vomissements, diarrhée, fièvre et perte de poids. Au cours de la semaine précédente, il a présenté des symptômes, associés à ce qui apparaissait être une sinusite aiguë bactérienne, qui ne s’étaient pas améliorés malgré la prise pendant sept jours d’un antibiotique et d’un corticoïde (prednisone).
L’examen clinique avait révélé la présence d’une importante rougeur douloureuse sur l’épaule gauche. Un traitement associant deux antibiotiques est entrepris, associé à une hydratation par voie intraveineuse. Deux jours plus tard, le patient est toujours fébrile, très affaibli et présente progressivement des signes d’atteinte cérébrale. Par ailleurs, les lésions cutanées se sont étendues, prenant l’apparence d’ecchymoses. De nouvelles sont apparues sur les flancs, la cuisse droite, dans la région abdominale. Elles sont sensibles à la palpation, certaines formant des cloques. L’aspect de ces lésions bulleuses pouvant évoquer une vascularite, le patient reçoit une dose de corticoïdes par voie intraveineuse. Une biopsie cutanée est effectuée à des fins d’analyse histopathologique.
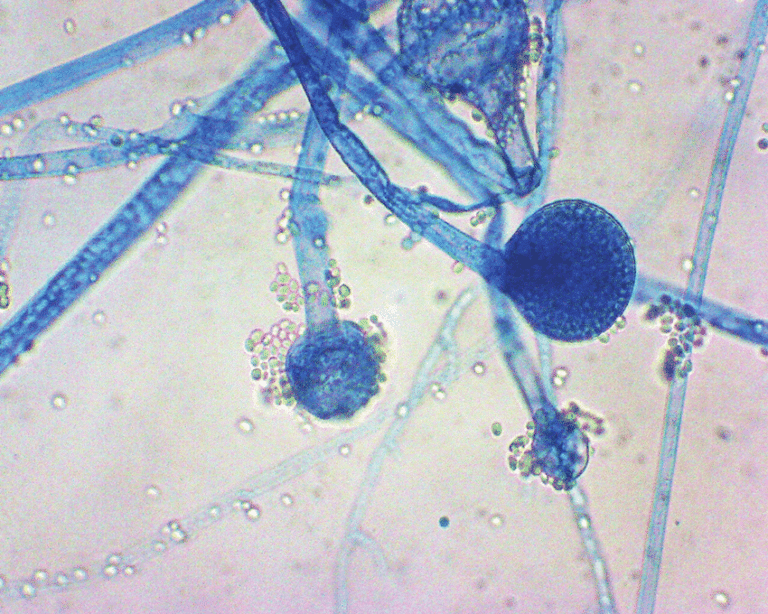
Deux jours plus tard, soit quatre jours après l’admission, comme le patient ne répond toujours pas favorablement à l’antibiothérapie à large spectre, il est décidé de commencer un traitement antifongique par voie intraveineuse dans la mesure où il pourrait s’agir d’une infection disséminée à champignons. Ce traitement débute avant même que les résultats de l’examen des prélèvements de tissus cutanés ne soient connus. Ceux-ci révèlent la présence de filaments larges non cloisonnés avec des ramifications à angle droit, ce qui correspond à une mucormycose, infection causée par un champignon appartenant à l’ordre des Mucorales, dont ceux appartenant aux genres Rhizopus, Rhizomucor et Mucor.
La mucormycose est une infection fongique rare et rapidement extensive. Elle est due à un microorganisme dit ubiquitaire, car présent dans différents milieux. Le champignon pathogène est fréquemment trouvé dans le sol, mais également dans la nourriture en décomposition et les excréments d’animaux.
L’inhalation de spores entraîne une mucormycose rhino-orbito-cérébrale. Cette localisation constitue la forme la plus agressive de cette infection fongique, qui atteint les cavités nasales et les sinus paranasaux. Les spores colonisent l’orbite dans la moitié des cas et peuvent se diffuser vers le cerveau. Les symptômes initiaux sont divers : douleurs de localisation sinusienne, fièvre, maux de tête.
La diffusion vers la région orbitaire, qui résulte de l’atteinte osseuse, entraîne une baisse de l’acuité visuelle, une paralysie des nerfs crâniens assurant les mouvements de l’œil (ophtalmoplégie), une anesthésie de la cornée, voire une cécité. De là, l’infection peut atteindre le système nerveux central. Chez un sujet diabétique, l’apparition d’une diplopie (perception de deux images d’un objet unique) doit impérativement évoquer une mucormycose comme possible diagnostic.
Mucormycose rhino-orbito-cérébrale, la forme la plus décrite
La mucormycose rhino-orbito-cérébrale touche essentiellement les patients immunodéprimés et les diabétiques, en particulier ceux qui sont en décompensation acidocétosique, autrement dit ceux qui présentent une complication aiguë du diabète, caractérisée par une acidité excessive du sang causée par l’accumulation de corps cétoniques. L’acidocétose diabétique est la conséquence d’une faible concentration sanguine en insuline en cas de diabète non diagnostiqué ou mal contrôlé par le traitement. Les principaux genres responsables de mucormycose sont Rhizopus, Mucor, Rhizomucor et Lichtheimia.
Rhizopus croît dans un environnement acide riche en glucose et cétones, ce qui fait que l’acidocétose diabétique et une hyperglycémie prolongée représentent des facteurs de risque. Les cas de mucormycose observés chez des patients diabétiques en acidose cétose laissent à penser que la baisse du pH sanguin pourrait provoquer une libération du fer à partir de la protéine à laquelle il est fixé. Il se produirait dans le sang une dissociation du fer de sa protéine transporteuse, ce qui augmenterait dans le sang le taux de fer libre. Or on sait que ce dernier diminue la capacité de phagocytose des cellules immunitaires (neutrophiles et macrophages) et de destruction des spores. Par ailleurs, le fer libre stimule la croissance des champignons et la prolifération des spores. Enfin, des spores pathogènes peuvent se développer à 37 °C et même se multiplier en cas de fièvre.
L’infection pulmonaire est la seconde localisation de la mucormycose. Des formes gastro-intestinales (après ingestion de spores à partir d’aliments contaminés), cutanées (par inoculation de spores dans une plaie cutanée) et disséminées sont rarement observées. En 2005, une méta-analyse a montré que la mucormycose rhino-orbito-cérébrale est la forme la plus fréquente chez les diabétiques, alors que les formes pulmonaires et disséminées sont plus souvent observées chez les patients greffés.
Le diabète mal équilibré, facteur de risque majeur
Les facteurs de risque sont notamment les affections provoquant une immunosuppression, telles qu’un diabète non contrôlé, une greffe de cellules souches hématopoïétiques, une greffe d’organe solide.
Un diabète non contrôlé et l’administration prolongée de corticoïdes durant la pandémie de Covid-19 ont entraîné une flambée de cas de mucormycose (improprement appelée “champignon noir”) en Inde. Après la deuxième vague de Covid-19, l’Inde a signalé plus de 40 000 patients atteints de mucormycose. Plusieurs cas de mucormycose pulmonaire liés à la Covid-19 ont également été rapportés au Pakistan, aux États-Unis, au Mexique, au Chili et en France et dans d’autres pays.
Cette infection fongique se manifeste par des nécroses autour des yeux, du nez et de la bouche, avec apparition de zones très sombres sur le visage.
Par ailleurs, des brûlures, des plaies chirurgicales et des traumatismes cutanés (causés par des accidents professionnels ou des catastrophes naturelles) peuvent précéder l’infection cutanée. Après inoculation, le microorganisme fongique prolifère.
Les manifestations cliniques de la mucormyocose sont caractérisées par l’angio-invasion, autrement dit par la capacité des spores à pénétrer dans les vaisseaux et diffuser par voie sanguine. Ce champignon est ainsi rapidement responsable de thromboses (obstructions de vaisseaux sanguins) et de nécrose des tissus.
Un diagnostic souvent établi avec retard
Sur un terrain diabétique, le site préférentiel de la mucormycose est la localisation rhino-orbito-cérébrale. Cette forme est responsable d’une forte mortalité, notamment du fait d’un retard diagnostique du fait de sa rareté et de difficultés à établir un diagnostic devant des symptômes non spécifiques. Du fait de la prévalence croissante du diabète dans le monde, le nombre de patients présentant cette infection potentiellement mortelle augmente rapidement.
Publiée en 2005 dans Clinical Infectious Diseases, une étude portant sur 929 cas de mucormycose a montré que le diabète est le principal facteur de risque (36 % des cas) et que la manifestation la plus fréquente est l’infection des sinus paranasaux, de l’orbite et du cerveau (66 % des cas).
Un pronostic conditionné par la rapidité et l’efficacité de la prise en charge médicale et chirurgicale
Les pronostics fonctionnel et vital dépendent pourtant d’un diagnostic rapide, qui est généralement fait à l’examen direct de tissus. L’examen microscopique montre la présence de filaments larges non septés (non cloisonnés) avec des ramifications à angle droit. L’examen doit être approfondi car de nombreuses plages de nécroses ne contiennent pas de microorganismes. Les cultures peuvent être négatives, même quand les filaments sont très bien visibles dans les tissus.
Le traitement consiste le plus souvent en l’administration d’amphotéricine B, qui demeure la thérapie de référence. De nouveaux antifongiques, homologués par la FDA aux États-Unis et l’Agence européenne du médicament (EMA) peuvent être utilisés (isavuconazole, poscanazole). Surtout, la prise en charge médicale doit, chaque fois que cela est possible, être associée à la chirurgie. Celle-ci consiste en un débridement chirurgical complet du tissu nécrotique, ces tissus morts devant être rapidement éliminés. L’exérèse du tissu infecté et nécrotique améliore l’efficacité médicamenteuse, en particulier lorsque les vaisseaux sanguins touchés sont thrombosés et que la microcirculation sanguine est altérée.
Même sous traitement agressif, la mortalité reste élevée. Publiée en 2011, une étude portant sur 230 cas de mucormycose (dont 27 % cas de mucormycose rhino-orbito-cérébrale) survenus dans 13 pays européens, a indiqué qu’un traitement antifongique associé à un débridement chirurgical s’accompagnait d’un taux de mortalité plus faible (24 %) qu’en cas de traitement médical seul (58 %) ou de chirurgie seule (44 %). Une exentération (intervention chirurgicale consistant en l’exérèse de la totalité du contenu orbitaire, laissant à nu les parois osseuses de l’orbite) est parfois réalisée. L’indication de cette procédure chirurgicale mutilante dépend de l’évolution des lésions.
L’évolution de la mucormycose est souvent fatale avec des taux de mortalité fluctuant entre 45 % et 64 % malgré les traitements antifongiques et chirurgicaux. Par ailleurs, la prise en charge thérapeutique comporte impérativement l’équilibration d’un diabète décompensé (traitement de l’hyperglycémie et de l’acidose).
Mais revenons au patient diabétique, dont le diabète était pourtant bien contrôlé et qui était visiblement immunocompétent. Son cas a été rapporté le 27 juillet 2022 par des médecins internistes américains dans la revue IDCases.
Débridement chirurgical du tissu nécrotique
L’examen de la biopsie cutanée a révélé la présence de filaments mycéliens à l’intérieur de vaisseaux sanguins et lymphatiques, évocateurs d’une maladie disséminée. Le patient a immédiatement reçu de l’amphotéricine B. Le débridement chirurgical du tissu nécrotique a porté sur de nombreuses régions, particulièrement étendues. Il a concerné le flanc droit (16 x 13 x 5 cm), la cuisse droite (16 x 13 x 2 cm), la région abdominale droite (15 x 20 x 2 cm), l’épaule gauche (16 x 13 x 2 cm) et le flanc gauche (18 x 13 x 3 cm). Il a également été profond, jusqu’au muscle squelettique sous-jacent.
Une fois opéré, le patient a été pris en charge par un centre de traitement des brûlés. Les six jours suivants, il a subi deux autres débridements chirurgicaux en même temps qu’un traitement d’agents antifongiques en perfusion continue par voie intraveineuse. Le patient a succombé peu de temps après, malgré tous les soins prodigués.
Chez ce patient, qui ne présentait pas de déficit immunitaire chronique, la mucormycose s’est sans doute développée à la faveur d’une légère immunosuppression induite par la prise de corticoïdes. Reste à déterminer la source de la contamination qui a entraîné une infection disséminée. Il s’avère que ce patient avait été hospitalisé deux mois avant la survenue des symptômes respiratoires pour une implantation d’un stimulateur cardiaque. Il est donc possible que le microorganisme fongique ait été introduit dans l’organisme de ce patient lors de la pose du pacemaker. Il s’agirait alors d’une infection nosocomiale, ce qui a déjà été décrit.
On peut également penser que ce patient a inhalé des spores et a par la suite développé une infection pulmonaire. Celle-ci a flambé lors de l’administration de corticoïdes par voie intraveineuse, ce qui a pu conduire à une immunosuppression et une hyperglycémie, deux circonstances qui favorisent la prolifération du champignon.
En tout état de cause, ce patient aurait dû bénéficier d’une biopsie cutanée dans les meilleurs délais. Le diagnostic de mucormycose repose principalement sur l’examen histologique et la mise en culture de l’échantillon clinique. Les biopsies tissulaires sont considérées comme des échantillons de choix. Dans le cas de ce patient qui présentait une large lésion sur l’épaule gauche, une biopsie cutanée aurait dû être réalisée à son admission.
Des techniques de PCR sont aujourd’hui disponibles pour l’identification des espèces de champignons responsables de mucormycose.
Une pathologie dévastatrice avec un taux de mortalité élevé
Chadley Froes et ses collègues du Grand Strand Medical Center (Myrtle Beach, Caroline du Sud), qui rapportent ce cas clinique, soulignent l’importance d’évoquer précocement le diagnostic de mucormycose lorsque surviennent des lésions cutanéo-muqueuses à progression rapide qui ne s’améliorant pas malgré l’instauration d’une couverture antibactérienne agressive à large spectre. « Bien que la mucormycose disséminée soit extrêmement rare, il est impératif de penser à cette infection fongique à propagation rapide et responsable d’une mortalité élevée », concluent-ils.
Un meilleur pronostic est observé chez les patients qui bénéficient d’un diagnostic rapide et d’un traitement antifongique précoce. Ainsi, le taux de survie est de 61 % avec une prise en charge thérapeutique dans un délai de douze jours après le début des symptômes, mais tombe à 33 % si celle-ci commence après treize jours ou plus. Chez les patients n’ayant pas de débridement chirurgical, le taux de survie n’est que de 21 %.
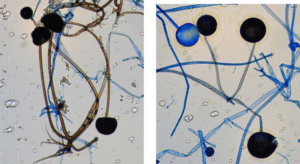
Les cas de mucormycose ont principalement été rapportés chez des patients des pays suivants : Iran (26 % des cas), Inde (22 %), Chine (17 %), États-Unis (15 %), Tunisie (5 %), Mexique (5 %) et Corée du Sud (2%). La majorité des patients ont plus de 50 ans. Dans la mucormycose rhino-orbitale, le taux de survie est inférieur à 50 %. Celui-ci n’est que de 15 % en cas d’atteinte cérébrale.
Des chirurgiens maxillo-faciaux suisses ont rapporté en avril 2022 un cas de mucormycose rhino-orbito-cérébrale dans la revue Oral Diseases. Ce cas concerne un homme de 74 ans présentant un gonflement persistant de la joue gauche et une vision double. Il se plaint également depuis trois semaines d’une légère douleur de la mâchoire gauche. Ce patient, qui vit avec un diabète de type II insulino-dépendant, présente une insuffisance rénale chronique modérée.
Le diagnostic de sinusite maxillaire aiguë, associé à une atteinte des tissus mous, est alors retenu. Deux jours plus tard, la douleur augmente et le patient présente une diminution de l’acuité visuelle. Il est alors décidé de pratiquer une antrotomie, intervention consistant à ouvrir le sinus maxillaire. Les chirurgiens découvrent alors un tissu inflammatoire qui s’étend jusqu’à l’orbite et qui est responsable d’une paralysie des mouvements oculaires (ophtalmoplégie totale) et d’une baisse d’acuité visuelle, témoin d’une atteinte du nerf optique*. Le contenu du sinus est évacué et drainé. Le volet osseux est replacé et la muqueuse est suturée.
L’analyse microbiologique révèle la présence d’un champignon Rhizopus, établissant le diagnostic de mucormycose rhino-orbito-cérébrale. Un traitement par amphothéricine B est immédiatement initié ainsi qu’un débridement chirurgical transnasal et orbitaire. Les chirurgiens retirent une partie de la paroi de l’orbite et du palais dur (ou voûte palatine).
L’IRM post-opératoire montre cependant que l’infection a progressé vers le cerveau. Il est alors décidé de procéder à une intervention particulièrement mutilante, consistant en l’ablation de tout le contenu orbitaire (exentération), avec résection du plancher de l’orbite, de la cloison nasale et des cornets nasaux du côte gauche. Cette procédure a été complétée par l’ablation d’une partie du maxillaire supérieur.
Après sept jours de traitement intraveineux par amphotéricine B à fortes doses, la posologie est revue à la baisse du fait d’une détérioration progressive des fonctions hépatique et rénale. La glycémie a cependant pu être rapidement stabilisée. Malgré tout cela, le patient est décédé huit jours après la dernière intervention chirurgicale d’une altération de la fonction des reins et du foie ayant entraîné une défaillance multiviscérale.
* Cette entité pathologique rare est désignée sous le nom de syndrome de l’apex orbitaire.