C’est l’histoire d’un homme de 54 ans qui présente une douleur du mollet gauche qui a augmenté en intensité depuis quelques jours. Le début a été brutal. Dans ses antécédents, on trouve un diabète de type 2 et une hypertension depuis plusieurs années. Ce patient souffre également de rétinopathie diabétique et de néphropathie diabétique. Il est hospitalisé.
L’examen clinique montre une tuméfaction douloureuse et une induration musculaire. Il n’y a pas de modification de la peau en regard de la zone douloureuse, notamment pas de rougeur. Les examens biologiques standard montrent un syndrome inflammatoire d’intensité sévère. Les enzymes musculaires (CPK, créatine phosphokinase) sont à la limite de la normale .
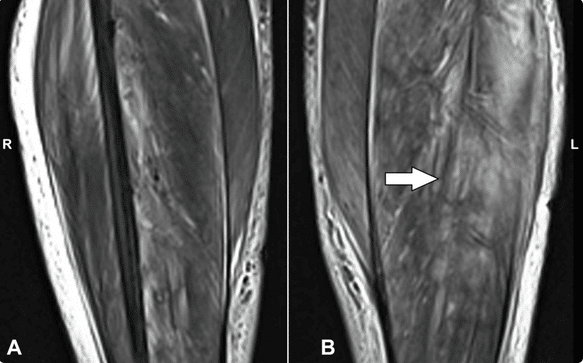
L’IRM des deux mollets a montré des signes évoquant ce que l’on appelle un infarctus musculaire diabétique (IMD). Il s’agit d’une complication rare, souvent méconnue du diabète, et de diagnostic difficile. Ce cas a été publié par des médecins indiens dans la revue en ligne Cureus, en même temps qu’un autre cas, survenu chez une Afro-américaine de 35 ans, dont le diagnostic de diabète de type 2 avait été posé un an auparavant. Cette patiente avait interrompu son traitement antidiabétique.
Une complication rare du diabète
La première description d’infarctus musculaire diabétique (IMD) remonte à 1965, date à laquelle deux médecins suédois de l’université de Göteborg, Angervall et Stener, ont rapporté deux cas de ce qu’ils nomment alors « dégénérescence musculaire focale tumoriforme ». Depuis, plusieurs cas ont été régulièrement publiés. On recense aujourd’hui environ 230 cas d’IMD dans la littérature médicale internationale. L’IMD est parfois dénommé myosite nécrosante diabétique (diabetic myonecrosis, en anglais).
L’infarctus musculaire diabétique correspond à une lésion de nécrose (mort du tissu musculaire) intéressant un muscle ou un groupe musculaire. L’IMD survient généralement lors d’un diabète évoluant depuis plusieurs années, souvent mal contrôlé et associé à d’autres complications (rétiniennes, rénales ou des nerfs périphériques). Des études ont ainsi montré qu’environ 46 % des patients ont une rétinopathie, une néphropathie ou une neuropathie et que 65 % d’entre eux présentent au moins deux de ces complications. Les patients souffrant d’IMD sont atteints d’un diabète de type 1 ou de type 2.
Douleur musculaire intense associée à une tuméfaction
Le principal symptôme de l’infarctus musculaire diabétique est une tuméfaction (grosseur) douloureuse du membre inférieur, d’apparition récente, sans facteur déclenchant, en particulier en l’absence de traumatisme. Le mode d’apparition de la douleur est généralement brutal et s’accompagne d’une impotence fonctionnelle marquée, autrement dit d’une diminution de la mobilité et donc une difficulté à se tenir debout ou à marcher.
On n’observe pas de modification de la peau en regard de la zone douloureuse, notamment pas de rougeur. La palpation profonde peut révéler une masse ou une tuméfaction. Le patient n’a généralement pas de fièvre.
La cuisse est le plus souvent atteinte
La cuisse est la région la plus souvent atteinte (dans plus de 55 % des cas), suivie du mollet (15 % des cas). Tous les groupes musculaires de la cuisse peuvent être en cause, les vastes internes et externes (quadriceps) étant les plus touchés. Les adducteurs ou les ischio-jambiers peuvent être affectés. L’atteinte musculaire est habituellement unilatérale et focale (localisée). Elle est bilatérale d’emblée dans environ 8 % des cas. L’atteinte du membre supérieur a été décrite, mais reste exceptionnelle.
L’IMD a une légère prépondérance féminine (54 %). L’âge moyen de survenue est de 44,6 ans. Le diagnostic de cette pathologie musculaire survient après une durée moyenne du diabète de 18,9 ans (entre 5 et 33 ans) pour le diabète de type 1 (DT1) et de 11 ans (entre 1 et 25 ans) chez les patients vivant avec un diabète de type 2 (DT2). Environ 75 % des patients souffrant d’IMD ont un diabète insuffisamment contrôlé. La valeur moyenne de l’hémoglobine glyquée (HbA1c, reflet de la glycémie des deux à trois derniers mois) est de 9,34 % (valeur normale : 6 %).
Les résultats des examens biologiques standard sont relativement non spécifiques. Ils montrent un syndrome inflammatoire d’intensité variable (CRP élevée), ce qui peut orienter à tort vers une arthrite inflammatoire et rendre le diagnostic difficile. Les enzymes musculaires (CPK, créatine phosphokinase) sont élevées à la phase précoce de la maladie, mais peuvent se situer dans les valeurs normales dans environ 68 % des cas. On observe souvent une hyperleucocytose (élévation du nombre des globules blancs). Le taux de globules blancs (leucocytes) est cependant dans les limites de la normale dans environ 56 % de cas.
L’IRM est l’examen de choix pour le diagnostic
L’échographie et le scanner montrent une augmentation de volume des muscles atteints. Ces signes ne sont pas spécifiques.
L’IRM du membre affecté est l’examen clé pour établir le diagnostic. Elle met en évidence un œdème des muscles qui apparaissent augmentés de volume (hypersignal en séquence pondérée T2 et un hyposignal T1 avec rehaussement net à l’injection d’un produit de contraste). Dans 90 % des cas, on trouve un œdème sous-cutané.
Le diagnostic de l’infarctus musculaire diabétique repose donc sur un faisceau de signes cliniques (induration musculaire douloureuse aiguë), des anomalies biologiques et sur des anomalies sur les images IRM.
Une bonne connaissance de cette complication rare du diabète permet d’éviter une biopsie dont certaines ont été émaillées de complications, en particulier des hémorragies répétées au site de l’intervention. En d’autres termes, en cas de présentation clinique typique chez un patient diabétique, l’IRM musculaire rend inutile ce geste invasif. De fait, la biopsie musculaire est réservée aux patients chez lesquels la progression d’une infection musculaire ne peut être exclue.
Le diagnostic de l’IMD reste difficile du fait que cette complication est rare et souvent méconnue des médecins, mais aussi car elle peut ressembler à d’autres pathologies. Il s’agit d’exclure d’autres affections plus fréquentes, telles qu’une pyomyosite (affection musculaire purulente), un abcès ou une infection. L’absence de fièvre et d’hyperleucocytose plaide contre ce diagnostic différentiel, en dépit de l’intensité du syndrome inflammatoire. Une thrombose veineuse profonde (caillot dans une veine de gros diamètre) doit être éliminée, de même qu’une cellulite (inflammation du tissu sous-cutané). La difficulté la plus grande est, dans les cas atypiques, d’écarter une tumeur musculaire.
En résumé, un infarctus musculaire diabétique doit être suspecté chez tout patient diabétique présentant une douleur musculaire de début brutal associée une tuméfaction d’un muscle.
Une pathophysiologie qui reste débattue
Les mécanismes physiopathologiques à l’origine de l’IMD reste peu clairs. Plusieurs hypothèses ont été soulevées, telles que l’athérosclérose, des lésions de microangiopathie diabétique (atteinte des vaisseaux intramusculaires) associées à des lésions d’hypoxie-reperfusion (cessation de l’apport sanguin, suivie d’une restauration de l’apport sanguin au tissu musculaire), une vascularite avec thrombose (maladie inflammatoire des vaisseaux sanguins avec formation d’un caillot). Des troubles de la coagulation (hypercoagulabilité) ont été décrits par certaines équipes.
La prise en charge thérapeutique de l’IMD n’est actuellement pas codifiée. Le traitement consiste en la mise au repos du membre atteint, ainsi qu’en la prise d’anti-inflammatoires non stéroïdiens (AINS) et en l’équilibration du diabète. Il permet une normalisation des symptômes en quelques jours à quelques semaines. Le plus souvent, la chirurgie n’est pas recommandée.
Un bon pronostic à court terme, mais un taux de récidive élevé
L’évolution se fait généralement vers une guérison en six à huit semaines. Une récidive n’est pas rare, survenant dans 35 % à 48 % des cas. Elle touche souvent différents groupes musculaires (dans 39 % à 61 % des cas).
Compte tenu de l’augmentation actuelle de la prévalence du diabète, il importe que les cliniciens sachent reconnaître les signes cliniques, biologiques et d’imagerie associés à cette pathologie rare afin de mettre en route une prise en charge adaptée et éviter des examens invasifs et des traitements inutiles (antibiotiques, chirurgie). En tout état de cause, la prévention de l’IMD passe par l’éducation des patients vivant avec un DT1 ou DT2 sur cette pathologie, l’observance de leur traitement antidiabétique et des mesures hygiéno-diététiques.
Marc Gozlan
(Suivez-moi sur X, Facebook, LinkedIn, Mastodon, Bluesky)