C’est l’histoire d’une Chinoise de 25 ans dont le diabète de type 1 a été diagnostiqué il y a douze ans. Après avoir bénéficié l’an dernier d’une greffe de cellules pancréatiques dérivées de cellules souches, elle peut aujourd’hui se passer totalement d’un traitement par l’insuline. Cette thérapie cellulaire a consisté à transformer certaines cellules de son corps en cellules souches qui ont ensuite été reprogrammées pour devenir des cellules productrices d’insuline. Un an après, cette femme produit sa propre insuline et n’est plus diabétique.
Ces résultats ont été publiés en ligne dans la revue Cell le 20 septembre 2024.
Cette patiente avait déjà bénéficié, en juillet 2014 et septembre 2016, de deux transplantations hépatiques car souffrant d’une cirrhose cryptogénique, c’est-à-dire d’une cirrhose dont la cause reste inconnue après exclusion des causes virales, auto-immunes, toxiques et métaboliques. Elle a par ailleurs bénéficié en mai 2017 d’une transplantation de pancréas entier du fait d’une grande instabilité du contrôle glycémique. Le greffon pancréatique avait cependant dû être retiré un an plus tard, en août 2018, du fait de complications thromboemboliques. La formation de caillots veineux est en effet une complication majeure en transplantation pancréatique car sa survenue entraîne la perte du greffon pancréatique dans la quasi-totalité des cas.
Avant de bénéficier de cette greffe de cellules souches reprogrammées pour devenir des cellules sécrétrices d’insuline, cette patiente n’en produisait pas. En effet, le taux de peptide C, qui renseigne sur la sécrétion endogène d’insuline, était indétectable, que cela soit à jeun ou lorsque les médecins lui faisaient consommer du glucose.
Malgré un lourd traitement insulinique (54 unités d’insuline par jour), cette patiente ne parvenait pas à obtenir un contrôle glycémique. Deux ans avant la greffe de cellules souches, son taux d’hémoglobine glyquée (HbA1c), reflet de la glycémie des deux à trois derniers mois, était compris entre 7,4 % et 8 % (valeur normale comprise entre 6,5 % et 7 %).
Trois mois avant la greffe, les mesures du glucose en continu avaient montré une grande instabilité de la glycémie. La patiente avait fait plusieurs épisodes hypoglycémiques, dont trois hypoglycémies sévères au cours des douze derniers mois. Sa glycémie à jeun, qui fluctuait grandement, était élevée, avec pour valeur moyenne 2,1 g/L.
Durant les trois mois précédant la transplantation cellulaire, le temps passé dans la cible (TIR pour time in range, qui exprime le pourcentage de temps passé par une personne diabétique dans la plage glycémique cible) était d’environ 43 %, bien inférieur à l’objectif recommandé de 70 %.
Cette patiente vivant avec un diabète de type 1, non contrôlé malgré un traitement intensif par insuline, a été jugée éligible pour participer à un essai clinique consistant à greffer des cellules d’îlots pancréatiques dérivées de cellules souches, provenant elles-mêmes de cellules de la patiente, en l’occurrence du tissu graisseux.
Prélèvement de tissu adipeux abdominal
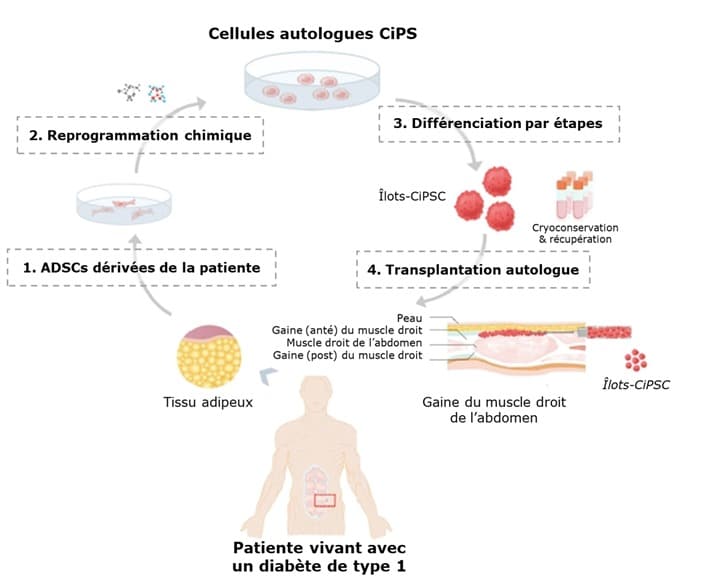
Le protocole a consisté à lui prélever du tissu adipeux. Ces cellules graisseuses, d’un volume de 30 millilitres, provenaient de la graisse abdominale. Elles ont été cultivées pour obtenir ce que l’on appelle des cellules stromales mésenchymateuses du tissu adipeux.
Ce sont ces cellules que les chercheurs ont forcé, sous l’effet de petites molécules, à devenir des cellules souches pluripotentes, c’est-à-dire pouvant ensuite être transformées en n’importe quel type de cellule de l’organisme. Ce sont elles qui se sont ensuite différenciées en îlots pancréatiques.
Des îlots dérivés de cellules souches
Ces cellules souches pluripotentes, dérivées de cellules adipeuses de la patiente, ont donc été reprogrammées chimiquement pour devenir des cellules d’îlots, dont la plupart produisent de l’insuline. Les chercheurs chinois les désignent par le sigle CiPSC (chemically induced pluripotent stem-cell-derived islets).
Avant de procéder à l’essai clinique, Shusen Wang, Deng Hongkui, Shen Zhongyang et leurs collègues des universités de Tianjin et Pékin ont transplanté des cellules d’îlots à 244 souris immunodéficientes afin de s’assurer qu’elles ne développeraient pas de tumeur. Ces expériences ont montré une bonne survie des îlots, l’absence de formation de tératome ou de prolifération anormale du greffon.
Injection des îlots dans le muscle droit de l’abdomen
Ces îlots sont de petits agrégats de cellules pancréatiques, renfermant environ 60 % de cellules bêta sécrétrices d’insuline. Ils ont été greffés, en juin 2023, à cette jeune femme, sous anesthésie générale. Les aiguilles fines qui contenaient les précieuses cellules ont été enfoncées sur une distance de 3 et 4 cm jusqu’à atteindre la gaine du muscle droit de l’abdomen, muscle de la paroi abdominale antérieure qui forme, avec son homologue du côté opposé, ce qu’on appelle les abdominaux dans le langage courant. L’intervention a été réalisée sous contrôle échographique. L’innocuité et l’efficacité de cette technique d’implantation de cellules d”îlots dérivées de cellules souches avait auparavant été évaluée chez des singes par cette équipe chinoise.
Le volume injecté était de six millilitres et correspondait à près de 1,5 million d’îlots-équivalents (IEQ), sachant qu’un IEQ renferme environ plus de 1 300 cellules d’îlots CiPSC.
Une patiente déjà sous traitement immunosuppresseur
Cette patiente avait des anticorps (anti-HLA de classe I et II) qui la prédisposaient à un risque accru de rejet et perte de greffon des îlots greffés. Les médecins ont donc renforcé le traitement immunosuppresseur qu’elle suivait depuis sa transplantation hépatique et qui comportait trois médicaments (tacrolimus, mycophenolate mofetil, méthylprednisolone). Afin de diminuer la réponse de son système immunitaire, la patiente a reçu un traitement d’induction comportant un anticorps monoclonal (basiliximab, pendant quatre jours suivant la greffe d’îlots CiPSC) et un immunosuppresseur (étanercept, trois injections durant les dix jours post-greffe).
Insulino-indépendance
Deux semaines après la transplantation cellulaire, la dose quotidienne d’insuline nécessaire pour traiter le diabète de la patiente a été diminuée, passant de 54 unités/jour à 43 unités/jour. Elle a pu totalement se passer d’insuline le 75e jour, parvenant à ce qu’on appelle une insulino-indépendance, et n’est plus traitée par insuline depuis exactement un an.
Les îlots CiPSC transplantés fonctionnent bien un an après la greffe dans la mesure où ils ont permis de rétablir une sécrétion endogène d’insuline. L’obtention de cette insulino-indépendance s’est accompagnée du rétablissement du contrôle glycémique.
Un temps dans la cible glycémique supérieur à 98 % quatre mois après la greffe
En effet, le TIR (temps passé par une personne diabétique dans la plage glycémique cible), qui était de 43 % avant la greffe, est passé à 87 % au deuxième mois post-transplantation et à 96 % au quatrième mois. Au bout d’un an, le TIR était supérieur à 98 %.
De même, la glycémie à jeun a progressivement diminué après la transplantation. Après l’obtention de l’indépendance vis-à-vis de l’insuline, la glycémie de la patiente s’est maintenue à un taux inférieur au seuil correspondant au diagnostic du diabète. Aucune hypoglycémie grave n’a été observée au cours du suivi d’un an post-greffe.
Diminution de l’hémoglobine glyquée à un niveau non diabétique
Parallèlement à l’amélioration du temps passé dans la cible et de la glycémie à jeun, la valeur de l’hémoglobine glyquée a également diminué. L’HbA1c est ainsi passée d’une valeur de base de 7,57 % à 6,50 % au 75e jour, ce qui correspond à un taux normal. Au 120e jour post-greffe, l’HbA1c avait diminué à 5,37 % et s’est depuis maintenue à ce niveau.
Par ailleurs, après la transplantation des îlots CiPSC, le taux sanguin de peptide-C, qui était indétectable à jeun, a augmenté dès la deuxième semaine après la transplantation.
Au cours du suivi d’un an, les médecins chinois n’ont observé aucune anomalie au niveau du site d’injection, notamment pas de croissance anormale ou de formation d’un tératome (tumeur bénigne ou maligne).
L’équipe chinoise a innové dans le protocole de thérapie cellulaire habituellement utilisé par les équipes travaillant à l’amélioration du diabète de type 1 en utilisant des cellules d’îlots dérivées de cellules souches. Tout d’abord, elle a opté pour une injection extra-hépatique. En effet, les autres équipes injectent les cellules dans la veine porte qui va au foie.
Surtout, l’obtention des cellules souches pluripotentes (capables de se différencier en n’importe quelle sorte de cellules de l’organisme à partir des propres cellules du patient) n’a pas été induite en utilisant la technique habituelle, qui repose sur l’utilisation de facteurs de transcription, des protéines jouant un rôle crucial dans la régulation de l’expression des gènes. Cette technique de reprogrammation de cellules adultes en cellules souches pluripotentes induites (iPS, induced pluripotent stem cells) avait valu en 2012 le prix Nobel de médecine au Japonais Shinya Yamanaka.
Reprogrammation chimique
Les chercheurs chinois ont utilisé une tout autre stratégie : par une reprogrammation chimique, ils ont induit la formation de cellules souches pluripotentes à partir de cellules adultes du tissu adipeux de la patiente en utilisant de petites molécules, à savoir des composés chimiques capables d’interférer avec certains processus biochimiques intracellulaires (plus précisément des voies de signalisation et des mécanismes épigénétiques). Ces petites molécules sont faciles à produire et aisément manipulables, ce qui est important dans un objectif de fabrication standardisée de cellules à visée thérapeutique dans le cadre d’une médecine personnalisée.
C’est la première fois que l’on transplante à une personne vivant avec un diabète des cellules d’îlots pancréatiques dérivées de cellules souches pluripotentes chimiquement induites (CiPSC). Il est encore trop tôt pour affirmer que la première patiente est guérie de son diabète de type 1. Cela ne sera possible qu’après un suivi d’au moins cinq ans.
Etant donné que la patiente était déjà sous traitement immunosuppresseur suite à sa greffe de foie, les chercheurs n’ont pas pu évaluer un éventuel risque de rejet des cellules souches pluripotentes transplantées. En effet, même si celles-ci dérivent des propres cellules de la patiente, on ne peut exclure totalement le risque que son système immunitaire les reconnaisse comme étrangères, de la même façon qu’il s’est auparavant attaqué aux cellules pancréatiques sécrétrices d’insuline en provoquant un diabète.
L’essai clinique chinois est toujours en cours. Il a depuis inclus deux autres patients, dont le suivi post-greffe atteindra un an en novembre prochain. L’objectif des investigateurs est de conduire un essai sur une dizaine, voire une vingtaine, de patients.
Essai clinique préliminaire de la firme américaine Vertex
Ce n’est pas la première fois que l’on rapporte des résultats encourageants en matière de transplantation de cellules d’îlots pancréatiques dérivées de cellules souches pluripotentes reprogrammées provenant du patient. En juin 2023 lors du congrès de l’American Diabetes Association, des chercheurs de la société américaine de biotechnologie Vertex (Boston, Massachusetts) ont communiqué les résultats d’un essai clinique de phase I/II conduit auprès de six patients atteints d’un diabète de type 1 et présentant des hypoglycémies sévères.
Ces patients ont été transplantés avec des cellules d’îlots, pleinement différenciées et productrices d’insuline, dérivées de cellules souches pluripotentes. Cette thérapie cellulaire a permis de rétablir la production d’insuline et d’obtenir un contrôle glycémique. Un des patients a atteint une insulino-indépendance, définie par l’arrêt de l’insuline exogène.
Bien que ces données disponibles soient limitées, il sera crucial d’évaluer le risque/bénéfice après publication des résultats obtenus de la totalité des patients traités par ce protocole. Dans le DT1, ce type de thérapie pourrait représenter, à terme, le traitement privilégié pour éliminer l’hypoglycémie sévère et améliorer considérablement le contrôle glycémique, à condition de pouvoir interrompre le traitement immunosuppresseur.
Greffe d’îlots dérivés de cellules souches dans le diabète de type 2
En avril 2024, une autre équipe chinoise, basée à Shanghai, a rapporté avoir transplanté avec succès des cellules productrices d’insuline dans le foie d’un patient atteint d’un diabète de type 2 (DT2). Cet homme de 59 ans, qui souffrait d’un DT2 depuis vingt-cinq ans, avait développé une insuffisance rénale (néphropathie diabétique au stade terminal) et avait subi une greffe de foie en 2017. Son diabète était devenu très difficile à contrôler depuis 2019.
Les cellules d’îlots étaient dérivées de cellules souches reprogrammées. Des cellules du sang circulant (cellules mononucléées du sang périphérique) avaient été prélevées sur le patient et reprogrammées in vitro en cellules souches pluripotentes. Ces dernières ont ensuite générées des cellules d’îlots pancréatiques qui ont alors été injectées au patient dans la veine porte, vaisseau qui transporte le sang jusqu’au foie.
À la 32e semaine post-greffe, le TIR (temps passé dans la cible glycémique), qui était initialement que de 56 %, a atteint 99 %. Il n’a pas été observé d’épisode hypoglycémique, ou d’hyperglycémie sévère, durant la période de suivi de 27 mois, rapporte l’équipe de Shanghai dirigée par Weihua Dong, Ming Zhang et Yongquan Shi (Institut de biochimie et biologie cellulaire et hôpital Changzheng) dans la revue Cell Discovery.
Ce patient a atteint une insulino-indépendance. Son traitement par insuline a progressivement diminué jusqu’à être complètement interrompu à la 12e semaine post-greffe. De plus, son traitement antidiabétique oral (acarbose et metformine) a également été allégé, puis arrêté après 56 semaines.
C’est la première fois qu’on rapporte le cas d’un patient ayant un diabète de type 2 traité avec succès par une thérapie cellulaire utilisant des cellules d’îlots dérivées de cellules souches pluripotentes autologues, c’est-à-dire provenant de son propre organisme.
On le voit, même si la transplantation de cellules d’îlots pancréatiques dérivées de cellules souches pluripotentes autologues n’en est qu’à ses débuts, tant dans le diabète de type 1 que celui de type 2, les résultats des premiers essais cliniques sont très encourageants.
Marc Gozlan