Toutes les personnes ayant perdu du poids, via des mesures hygiéno-diététiques, un traitement médical ou une chirurgie bariatrique, le savent que trop bien : elles risquent rapidement de reprendre du poids. Se pourrait-il que cela tienne au fait que l’organisme garde une mémoire de l’obésité qui contrecarre les changements de poids corporel ? Des chercheurs suisses rapportent, dans un article paru le 18 novembre 2024 dans la revue Nature, que le tissu adipeux garde effectivement une mémoire de l’obésité après une perte de poids. Cette mémoire pourrait contribuer au fameux effet yo-yo, à savoir une reprise de poids rapide après un programme d’amaigrissement.
Ce n’est pas la première fois que des études tentent d’appréhender les mécanismes associés à une telle mémoire. La plupart d’entre elles visaient à analyser l’ensemble du tissu adipeux dans son ensemble. En revanche, cette nouvelle étude a consisté à rechercher cellule par cellule la présence dans leur noyau de signatures particulières possiblement associées à cette mémoire. Les mécanismes en cause relèvent de ce que l’on appelle l’épigénétique.
L’épigénétique désigne des processus qui gouvernent l’activité des gènes, mais sans que la séquence de l’ADN ne soit modifiée. Les mécanismes épigénétiques sont associés en effet à la régulation de l’activité des gènes, ce qu’on appelle l’expression génique.
L’expression correcte des gènes est nécessaire à l’identité des cellules
Il faut savoir que le développement, la différenciation et le maintien de l’identité des cellules adipeuses (cellules graisseuses) dépendent de mécanismes épigénétiques. Ce sont eux qui font qu’une cellule adipeuse reste une cellule adipeuse, autrement dit qu’elle ne perd pas son identité.
On parle d’épigénome pour désigner l’ensemble des modifications épigénétiques au sein d’une cellule.
L’épigénétique joue un rôle clé dans l’activation ou la répression de l’expression des gènes
Un des acteurs principaux participant aux processus épigénétiques est la méthylation de l’ADN, qui consiste en des ajouts sur l’ADN de groupes méthyl par des enzymes spécialisées. Ces modifications sont matérialisées par des « marques » (ou « étiquettes ») biochimiques. Le nombre et la position des marques épigénétiques sont des critères déterminants pour réguler l’expression d’un gène donné.
Cette marque épigénétique est classiquement associée à la répression de l’expression du gène concerné, ce qui revient à dire que l’information contenue dans la séquence ADN du gène n’est plus transcrite en ARN messager et que la protéine codée par le gène en question n’est donc pas synthétisée. On parle alors d’inhibition de l’expression génique (downregulation). Dans d’autres cas, les changements épigénétiques induisent au contraire une suractivité des gènes concernés, qui sont donc surexprimés. On parle alors de surexpression génique (upregulation).
Outre la méthylation de l’ADN, il existe un autre mécanisme épigénétique majeur. Pour comprendre, il faut savoir que l’ADN est enroulé autour de protéines, les histones.
L’ajout de groupes chimiques sur ces histones conditionne le compactage de ces enroulements et peut modifier l’accessibilité de certains gènes à la machinerie de transcription qui conduit à la synthèse de l’ARN messager à partir de l’ADN. Au total, les mécanismes épigénétiques induisent ce qu’on appelle des « modifications transcriptionnelles », car elles se traduisent par des changements de l’activité des gènes.
Laura Hinte, Ferdinand von Meyenn et leurs collègues du laboratoire de nutrition et d’épigénétique métabolique de l’École polytechnique fédérale de Zurich (ETH Zurich) ont entrepris de déterminer s’il existe une mémoire cellulaire induite par l’obésité et si celle-ci est corrélée à des mécanismes épigénétiques.
Il s’agissait donc pour ces chercheurs de caractériser l’épigénome de cellules adipeuses et pour ce faire, ils ont séquencé les ARN présents dans le noyau (snRNA-seq, single-nucleus RNA sequencing) de chaque type de cellules contenues dans des échantillons de tissu adipeux provenant de souris minces, obèses, ou anciennement obèses.
Les chercheurs suisses ont également analysé le tissu adipeux humain. Afin d’explorer l’épigénome des cellules adipeuses après une perte de poids conséquente, ils ont utilisé le tissu adipeux sous-cutané et de la graisse viscérale (tissu adipeux omental). Ces échantillons graisseux ont été obtenus à partir de biopsies réalisées chez des individus de poids normal (n’ayant jamais présenté d’obésité), de personnes vivant avec une obésité (mais sans diabète). Dans ce cas, les prélèvements de tissu adipeux ont été effectués avant chirurgie bariatrique et deux ans plus tard. N’ont été inclus dans l’étude que des patients qui avaient eu une réduction d’au moins 25 % de leur indice de masse corporelle (IMC) après chirurgie bariatrique.
Analyse du tissu adipeux de patients opérés par chirurgie bariatrique
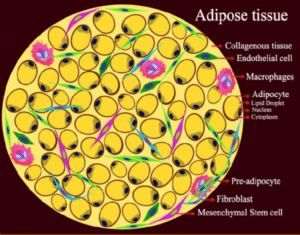
Le tissu adipeux analysé provenait de personnes qui participaient à des études cliniques. Des échantillons de biopsies de tissu adipeux omental et/ou sous-cutané abdominal provenaient de personnes ayant subi une sleeve gastrectomie (réduction du volume de l’estomac) puis un bypass gastrique avec Roux-en-Y (BPGY). D’autres échantillons de tissu adipeux omental et de la graisse abdominale sous-cutanée ont été prélevés avant et après un bypass gastrique avec Roux-en-Y (BPGY), ainsi que chez des sujets sains contrôles n’ayant jamais été obèses. Les prélèvements de tissu adipeux provenaient de patients ayant participé à différentes études de cohortes menées dans des hôpitaux de Leipzig, Dresde, Karlsruhe, et à l’Institut Karolinska de Stockholm.
Les résultats montrent que de nombreux gènes de cellules du tissu adipeux sous-cutané et omental dont l’expression était altérée au moment de la chirurgie chez les sujets obèses (par rapport aux sujets sains) présentaient encore des modifications de leur activité deux ans plus tard. Au sein du tissu adipeux, il s’avère que les modifications transcriptionnelles induites par les mécanismes épigénétiques sont particulièrement prononcées dans les adipocytes et les cellules endothéliales.
Les chercheurs se sont ensuite focalisés sur les seuls adipocytes compte tenu du fait que ces cellules conservaient des modifications transcriptionnelles dans chacun des échantillons du tissu adipeux analysés. L’analyse de l’expression des gènes d’adipocytes provenant des patients de chacune des cohortes de chirurgie bariatrique a révélé que l’expression de nombreux gènes impliqués dans le métabolisme et la fonction de ces cellules est réprimée de façon persistante et, qu’à l’inverse, des gènes impliqués dans la fibrose étaient surexprimés.
Ces résultats montrent donc que l’obésité induit des changements cellulaires et transcriptionnels dans le tissu adipeux qui ne disparaissent pas après une perte de poids significative.
Les chercheurs ont ensuite conduit une série d’expériences sur des souris de laboratoire. Ils ont ainsi testé la persistance de changements de l’expression génique (modifications transcriptionnelles) chez des rongeurs alternativement soumis à une alimentation riche en graisses pendant des durées plus ou moins longues (12 ou 25 semaines).
Deux premiers groupes de rongeurs ont été étudiés : des souris ont été nourries pendant 12 semaines, ou 25 semaines, avec une alimentation pauvre en graisses, puis avec ce même régime pendant 8 semaines. Enfin, deux autres groupes ont été constitués : des souris ont reçu pendant 12 semaines, ou 25 semaines, un régime riche en graisses, après quoi elles ont été nourries avec un régime pauvre en graisses pendant 8 semaines.
Les chercheurs ont analysé la graisse sous-cutanée au niveau de l’aine de ces rongeurs ainsi que le tissu adipeux épididymaire. Ce dernier, situé près de la gonade, est classiquement étudié chez des modèles d’obésité induite chez la souris par un régime riche en graisses.
Persistance de modifications transcriptionnelles dans le tissu adipeux après la perte de poids
Les chercheurs indiquent que chez les souris obèses, et celles qui ont perdu du poids, le tissu adipeux renferme de nombreuses modifications transcriptionnelles dans les adipocytes, les précurseurs des adipocytes, les cellules endothéliales et les macrophages. De fait, les chercheurs ont montré que l’expression de nombreux gènes qui est dérégulée pendant l’obésité demeure altérée après la perte de poids.
Les chercheurs ont observé que l’expression de certains gènes était revenue à la normale chez les souris qui avaient reçu un régime riche en graisses pendant 12 semaines puis avaient été nourries avec un régime pauvre en graisses pendant 8 semaines. En revanche, aucun de ces gènes n’avait une expression normale chez les souris qui avaient reçu un régime riche en graisses pendant 25 semaines avant de recevoir un régime pauvre en graisses pendant 8 semaines. Ceci indique que plus la durée de l’obésité est importante, plus l’impact en termes de modifications transcriptionnelles se fait sentir. En d’autres termes, plus l’obésité perdure, plus les cellules du tissu adipeux conservent une mémoire de l’état obésogène.
Chez la souris, après une perte de poids, il s’avère que les adipocytes renferment des gènes impliqués dans l’inflammation et la fibrose (formation d’une quantité anormalement abondante de tissu conjonctif cicatriciel) qui sont surexprimés et que l’expression de gènes participant au métabolisme spécifique de ces cellules est au contraire inhibée. Ces résultats sont donc similaires à ce que l’on observe dans les adipocytes de patients obèses opérés par chirurgie bariatrique.
Les chercheurs ont ensuite exploré les mécanismes responsables de cette mémoire métabolique de l’obésité. Ils ont étudié en détail les signatures épigénétiques d’un très grand nombre de gènes dans les cellules composant chaque échantillon de tissu adipeux épididymaire des souris étudiées. Ils ont ainsi identifié la persistance de marques épigénétiques spécifiques sur des régions de l’ADN connues pour activer (promoteurs) ou amplifier (enhancers) l’expression de certains gènes.
Selon les chercheurs, les changements épigénétiques observés pourraient expliquer, d’une part, la diminution persistante de l’expression de nombreux gènes dont l’activité est altérée, et d’autre part, l’augmentation de l’expression de nombreux gènes qui sont au contraire surexprimés.
Par ailleurs, il s’avère que les souris qui avaient reçu pendant 25 semaines un régime riche en graisses, puis avaient été nourries avec un régime pauvre en graisses pendant 8 semaines présentaient 3 à 6 fois plus de modifications d’expression génique que les souris qui avaient reçu un régime riche en graisses durant 12 semaines (soit deux fois moins longtemps) avant de recevoir un régime pauvre en graisses pendant 8 semaines. Plus précisément, il semble que certaines modifications sur les histones soient responsables de la surexpression d’environ 30 % des gènes dont l’expression est surexprimée, qui sont impliqués dans l’inflammation, et d’environ 60 % de gènes dont l’activité est au contraire réprimée, qui participent à la fonction et au maintien de l’identité des adipocytes.
Mémoire métabolique des adipocytes
Les chercheurs ont enfin conduit des expériences in vitro afin de savoir si la mémoire épigénétique se traduit par une mémoire métabolique, à savoir si des adipocytes de souris répondent différemment à des stimuli nutritionnels. Ils ont ainsi montré que les adipocytes du tissu adipeux inguinal provenant de souris qui avaient maigri après avoir été soumises pendant 25 semaines à un régime riche en graisses captaient plus de glucose que des cellules adipeuses normales. De même, le tissu adipeux de ces souris accumule plus de lipides que celui de souris contrôles.
Une mémoire épigénétique liée à l’obésité inscrite dans le noyau des cellules adipeuses
Au total, ces résultats indiquent la persistance d’une mémoire épigénétique liée à l’obésité et qui contribue à une réponse transcriptionnelle altérée dans les adipocytes. Chez l’être humain, il est donc possible que cette mémoire persiste dans le tissu adipeux après une perte de poids.
Ces résultats ne constituent cependant pas une preuve définitive de l’existence d’une relation de causalité entre la mémoire épigénétique du tissu adipeux et le phénomène du yo-yo. Ils montrent seulement une corrélation possible entre la persistance d’une expression génique altérée dans le tissu adipeux et une reprise du poids.
Il est à noter qu’en janvier 2023 une étude canadienne, parue dans la revue Science, avait montré qu’un régime riche en graisses induisant une obésité chez la souris entraîne des changements épigénétiques et que ceux-ci persistent, même après la perte de poids, dans les macrophages sur des gènes impliqués dans l’inflammation. Chez des souris contrôles qui avaient subi expérimentalement une lésion de l’œil, la transplantation de tissu adipeux provenant de souris qui avaient connu une perte de poids après avoir été obèses s’est accompagnée d’une augmentation de l’inflammation oculaire. Preuve que le tissu adipeux transplanté renfermait des gènes associés à l’inflammation dont l’expression était restée altérée.
Les chercheurs zurichois n’excluent pas que d’autres cellules que les adipocytes et les macrophages puissent conserver une mémoire épigénétique de l’obésité. Des recherches supplémentaires sont nécessaires pour déterminer si des fibres musculaires ou des neurones conservent ce type de mémoire et si celle-ci contribue à la reprise de poids souvent observée après des régimes alimentaires stricts. On ignore aussi pendant combien de temps des cellules conservent une mémoire épigénétique de l’obésité et si celle-ci peut disparaître au fil du temps.
Reste aussi à déterminer si les nouveaux médicaments de l’obésité (agonistes des récepteurs du GLP-1) pourraient effacer, ou diminuer, la mémoire obésogène.
Selon les chercheurs suisses, si la mémoire épigénétique de l’obésité dans les adipocytes, voire dans d’autres cellules de l’organisme, devait se révéler jouer un rôle causal dans la reprise du poids, cela pourrait ouvrir la voie vers de nouveaux traitements visant à améliorer la perte pondérale après un état d’obésité.
En attendant, il importe de faire le maximum d’efforts pour garder son poids après en avoir perdu. Il faut aussi tout faire pour éviter d’être en situation d’obésité afin que des cellules ne conservent pas une mémoire épigénétique qui pourrait entraver le maintien à long terme des bénéfices d’une perte de poids. On l’aura compris : la prévention de l’obésité s’avère cruciale.
Marc Gozlan (Suivez-moi sur X, Facebook, LinkedIn, Mastodon, Bluesky)