C’est l’histoire d’un homme de 53 ans, vivant depuis de nombreuses années avec un diabète de type 2, qui consulte pour des mouvements anormaux qui ont commencé, il y a trois semaines, au bras droit et à la jambe droite, puis sont apparus sur le visage. Involontaires, ils s’améliorent pendant le sommeil et n’affectent pas le côté gauche du corps.
Chez ce patient, le taux d’hémoglobine glyquée (HbA1c) a augmenté, passant de 8 % à plus de 15 % (valeurs normales : 6 %). Le bilan biologique révèle une glycémie très élevée : 5,6 g/L, sans cétose (absence de corps cétoniques). Ce mauvais contrôle glycémique intervient dans un contexte de dépression aggravée, suite au décès d’un membre de la famille et d’une mauvaise observance du traitement antidiabétique. Cet homme n’a pas d’antécédents familiaux de maladie neurologique avec trouble des mouvements. Il ne boit pas d’alcool.
Mouvements anormaux de l’hémicorps, d’apparition brutale
À l’examen clinique, il présente des mouvements irrépressibles du bras droit et de la jambe droite, ainsi que des mouvements intermittents du côté droit du visage. Il présente ce que les neurologues appellent un hémiballisme et une hémichorée. Ces deux termes désignent des mouvements anormaux, non rythmiques et non stéréotypés.
L’hémiballisme se caractérise cliniquement par des mouvements brusques, irréguliers, involontaires, irrépressibles et de grande amplitude impliquant la moitié du corps, notamment l’épaule et la hanche. La chorée est caractérisée par des mouvements anormaux involontaires, non rythmiques, survenant de manière brusque, explosive, imprévisible et sans finalité. On parle d’hémichorée quand ces mouvements n’affectent que la moitié du corps (hémicorps).
Hémichorée-hémiballisme avec hyperglycémie sans cétose
Ce patient présente donc une hémichorée-hémiballisme avec hyperglycémie sans cétose, témoin d’un déséquilibre de son diabète.
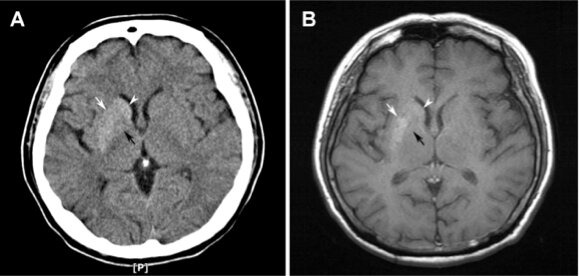
L’imagerie par résonance magnétique (IRM) du cerveau du patient montre une hyperdensité du noyau lenticulaire gauche (sur les séquences en T1), structure qui comprend le putamen (dans sa partie externe) et le pallidum (dans sa partie interne).
Après ajustement de son traitement par insuline, le contrôle glycémique a été amélioré (HbA1c à 9,4 %), mais les symptômes n’ont que peu régressé.
Le patient a alors reçu un antipsychotique (rispéridone), qui s’est montré très efficace sur les mouvements. L’évolution a été satisfaisante sur le plan clinique avec régression totale des mouvements anormaux au bout de six mois. Il n’y a pas eu de rechute.
Ce patient présente une hémichorée-hémiballisme hyperglycémique non cétosique, qui est une complication neurologique rare d’un diabète sucré décompensé, principalement le diabète de type 2 (DT2).
Ce syndrome se caractérise par des mouvements anormaux d’hémichorée et/ou d’hémiballisme associés à des anomalies de signal à l’IRM cérébrale. Celles-ci siègent au niveau du striatum (également appelé corps strié). Cette région du cerveau est constituée du noyau caudé et du putamen. Elle fait partie des ganglions de la base (également appelés noyaux gris centraux), Ces structures interconnectées, situées profondément dans chaque hémisphère cérébral, sont impliquées dans le contrôle moteur (posture, tonus, mouvements).
Striatopathie diabétique
L’hémichorée-hémiballisme résulte d’une atteinte du striatum controlatéral. En d’autres termes, les mouvements anormaux apparaissent au niveau de l’hémicorps opposé au côté de la lésion cérébrale. Ils disparaissent pendant le sommeil et s’intensifient lors des émotions (situations de stress). Parce que ce syndrome a son origine dans le striatium, un autre nom lui a été attribué il y a environ une décennie. On parle ainsi indifféremment de striatopathie* diabétique ou d’hémichorée-hémiballisme hyperglycémique non cétosique.
Plus de 96 % des patients atteints d’hémichorée-hémiballisme ont un diabète de type 2 (DT2), dont un sixième avec un diabète nouvellement diagnostiqué, ce qui indique que ce syndrome peut parfois être une des premières manifestations du diabète.
Dans plus de 90 % des cas, les mouvements normaux affectent un hémicorps, mais ceux-ci sont bilatéraux dans 9,7 % des cas. Le début et la distribution des mouvements varient d’un patient à l’autre. Dans certains cas, ils débutent brusquement, tandis que dans d’autres, ils apparaissent de façon insidieuse et augmentent en amplitude.
La lésion initiale peut être prise à tort pour une hémorragie aiguë
La prévalence de la striatopathie diabétique est d’environ 1 cas sur 100 000 personnes. Elle est sans doute largement sous-estimée du fait que la plupart des médecins ne connaissent pas ce syndrome qui peut être parfois pris à tort pour une hémorragie de cause hypertensive, et être traité alors de façon inappropriée.
Ces deux pathologies peuvent être distinguées l’une de l’autre. En effet, dans la striatopathie diabétique, on n’observe pas de compression ou de déviation d’autres structures intracérébrales (on parle d’absence d’effet de masse), ni d’anomalie au niveau de la capsule interne, voie de passage de nombreux faisceaux neuronaux. Cette importante zone de substance blanche est en effet épargnée dans la striatopathie diabétique.
Le syndrome d’hémichorée-hémiballisme hyperglycémique sans cétose a été décrit pour la première fois en 1960. À ce jour, plus de 150 cas de ce syndrome ont été publiés dans la littérature médicale, principalement chez des femmes d’origine asiatique présentant un DT2 non contrôlé. Plusieurs observations cliniques concernent cependant des personnes caucasiennes ou hispaniques (vivant en Europe, Amérique du Nord et du Sud). La prédominance féminine est probablement due à un sous-diagnostic plutôt qu’à une différence réelle dans le sex-ratio.
Des mécanismes physiopathologiques encore mal connus
Plusieurs mécanismes ont été proposés pour expliquer la survenue de ces mouvements anormaux dans le contexte d’une hyperglycémie sans cétose. Ils restent discutés. Il existe deux théories principales : métabolique et vasculaire.
Selon la théorie métabolique, au cours de l’hyperglycémie, le métabolisme cérébral passe en anaérobiose, avec pour conséquence une inactivation du cycle de Krebs. Le cerveau utilise alors l’acide gamma-aminobutyrique (GABA) comme source alternative d’énergie. Cependant, l’énergie fournie à partir du GABA n’apporte que 10 % à 40 % de celle nécessaire pour le fonctionnement des noyaux de la base, ce qui entraîne une acidose métabolique. Les taux de GABA et de l’acétate sont rapidement épuisés. En raison de la carence en acétate, la synthèse de l’acétylcholine est également réduite. L’épuisement de ces deux neurotransmetteurs, GABA (principal neurotransmetteur inhibiteur) et acétylcholine, dans les ganglions de la base, en combinaison avec le manque d’énergie et l’acidose métabolique, serait à l’origine d’un dysfonctionnement des ganglions de la base, et donc de l’apparition des mouvements anormaux.
Selon la théorie vasculaire, au cours de l’hyperglycémie, il se produit une hyperviscosité sanguine, qui entraînerait une hypoperfusion du striatum. La vascularisation de cette structure serait donc insuffisante. D’autres facteurs vasculaires ont été incriminés dans l’apparition des mouvements choréiques, comme l’acanthocytose, une anomalie morphologique des globules rouges qui semblent hérissés de spicules. Cette déformation des hématies serait responsable d’une mauvaise oxygénation (ischémie) et d’un dysfonctionnement transitoire des neurones du striatum.
La prédominance relative de la striatopathie diabétique chez les femmes ménopausées pourrait être expliquée par un effet indirect du statut hormonal. En effet, les œstrogènes peuvent diminuer la fonction de la dopamine. À la ménopause, la concertation en œstrogènes diminue, entraînant une hypersensibilité des récepteurs à la dopamine dans le striatum, ce qui prédispose à développer des mouvements anormaux.
Enfin, un dernier mécanisme vasculaire a été incriminé, à savoir des microhémorragies, responsables de lésions au niveau des ganglions de la base.
Sur le plan radiologique, l’hémichorée-hémiballisme hyperglycémique sans cétose est caractérisée à l’IRM par la présence d’un hypersignal spontané au niveau des ganglions de la base. Au scanner, on observe une hyperdensité. On observe rarement des lésions bilatérales.
Hypersignal à l’IRM dans le striatum
Un hypersignal spontané dans le striatum est observé à l’IRM cérébrale. L’anomalie siège le plus souvent dans le putamen controlatéral (du côté opposé aux mouvements anormaux), suivie par l’implication simultanée du putamen et du noyau caudé. L’IRM est l’examen d’imagerie le plus sensible pour détecter les anomalies du striatum associés à la striatopathie diabétique dans la mesure où des patients, chez lesquels on ne détecte pas de lésions au scanner, peuvent présenter des anomalies striatales à l’IRM.
De nombreuses hypothèses, controversées, ont été émises pour expliquer les anomalies observées à l’imagerie cérébrale, notamment la survenue de micro-hémorragies, la présence d’astrocytes réactifs gonflés (dénommés gemistocytes), des lésions de démyélinisation, des dépôts de minéraux (magnésium), des micro-calcifications. À ce jour, il n’existe aucune certitude quant à la cause des anomalies observées au scanner et à l’IRM et s’il s’agit des mêmes altérations sur ces deux examens d’imagerie.
Dans certains cas, la striatopathie diabétique est survenue une semaine à un mois après un épisode hyperglycémie, même après un contrôle raisonnable de la glycémie. Quand la glycémie est normale (euglycémie), le mécanisme de l’hémichorée-hémiballisme pourrait être dû à un effet ischémique retardé de l’hyperglycémie. Il est donc important d’avoir à l’esprit que la striatopathie diabétique peut parfois survenir plusieurs semaines après un contrôle glycémique optimal.
Bien que la striatopathie diabétique soit une complication rare d’un diabète déséquilibré, ce syndrome est la seconde cause d’hémiballisme-hémichorée, après les événements cardiovasculaires impliquant les ganglions de la base (AVC ischémiques et hémorragiques).
La prise en charge comporte un contrôle strict de la glycémie
La correction rapide de l’hyperglycémie par insulinothérapie et l’hydratation représentent la base du traitement de l’hémichorée-hémiballisme hyperglycémique sans cétose. Le pronostic est le plus souvent favorable, ce qui rend indispensable un diagnostic précoce.
La régression totale des mouvements anormaux peut prendre de quelques jours à environ dix mois après la correction de l’hyperglycémie. Elle survient en moyenne en l’espace de cinq à six mois.
La régression des symptômes cliniques s’observe seulement chez un quart des patients avec le seul contrôle de la glycémie. La plupart des patients ont besoin de recevoir un traitement complémentaire pour lutter contre les mouvements anormaux. Les médicaments utilisés appartiennent principalement à cinq classes : les antipsychotiques, les agents induisant une déplétion en dopamine, les benzodiazépines, les anticonvulsivants, les inhibiteurs de la recapture de la sérotonine.
L’évolution est parfois marquée par la réapparition des mouvements anormaux. Il arrive en effet que certains patients rechutent à l’arrêt du traitement, après un délai compris entre deux mois et deux ans après l’épisode initial. On observe un taux élevé de rechute, d’environ 20 %, ce qui implique de maintenir un suivi régulier indépendamment des résultats de l’imagerie cérébrale.
Pour conclure, on retiendra que l’apparition brutale de mouvements involontaires d’un côté du corps chez un patient diabétique doit faire évoquer le diagnostic de striatopathie diabétique. Il importe alors d’établir un diagnostic précoce en recherchant une anomalie du striatum à l’IRM cérébrale (hypersignal sur les séquences pondérées en T1). Un traitement rapide, avec normalisation de la glycémie, permet une régression des symptômes.
Marc Gozlan (Suivez-moi sur X, Facebook, LinkedIn, Mastodon, Bluesky)