C’est l’histoire d’un homme de 30 ans atteint de leucémie aiguë myéloïde qui est devenu diabétique quelques jours après avoir reçu une greffe de sang de cordon. Des hématologues japonais rapportent ce cas unique dans le numéro de novembre 2022 du Journal of Diabetes Investigation.
La transplantation de cellules-souches hématopoïétiques du cordon ombilical est une procédure qui offre des perspectives de guérison aux patients atteints d’une leucémie, notamment ceux souffrant d’une leucémie aiguë myéloïde (LAM). Dans la LAM, il y a surproduction de cellules souches anormales. Appelées blastes, ces cellules immatures envahissent la moelle osseuse qui ne peut alors plus assurer la production de cellules sanguines normales (globules blancs, globules rouges, plaquettes).
Le traitement principal de la LAM est la chimiothérapie. Elle a pour but d’obtenir une rémission complète, définie par la disparition de tous les signes de la maladie et par le fait que les blastes anormaux ne sont plus détectables dans la moelle osseuse et le sang.
Après rémission complète, les médecins peuvent alors envisager d’administrer un traitement dit « de consolidation ». Celui-ci vise à empêcher les cellules leucémiques de réapparaître et donc de maintenir une rémission complète et prévenir la récidive.
Ce traitement post-rémission peut consister en une greffe de cellules souches hématopoïétiques (CSH), prélevées sur une personne en bonne santé. On parle d’allogreffe lorsque le donneur est une personne différente du receveur. L’allogreffe de CSH repose sur la destruction de la moelle osseuse du receveur qui se voit remplacée par celle du donneur.
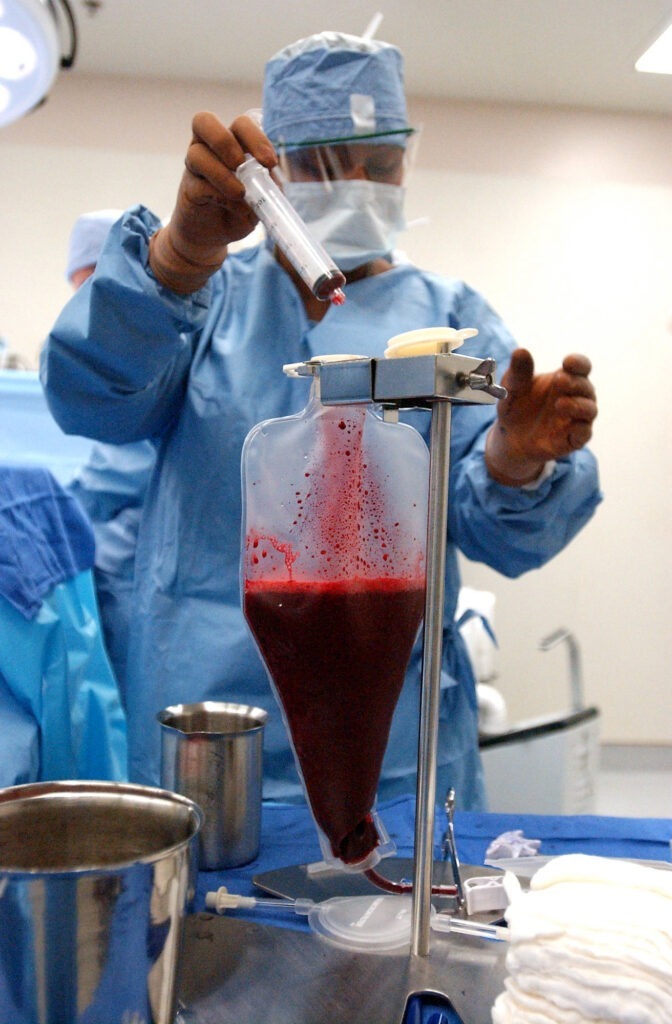
Les cellules utilisées pour les greffes de CSH proviennent le plus souvent de la moelle osseuse d’un donneur (apparenté ou non au patient) ou du sang provenant du cordon ombilical à la naissance d’un bébé. En effet, les cellules souches de sang ombilical contiennent un grand nombre de cellules souches hématopoïétiques, qui se transforment en globules rouges, globules blancs et plaquettes. L’objectif de la greffe de CSH est la reconstitution d’un système sanguin et immunitaire sain à partir des cellules hématopoïétiques transplantées.
Cette greffe allogénique de CSH nécessite de trouver un donneur compatible dans la fratrie. Dans environ 80 % des cas, celui-ci est un frère ou une sœur du receveur. Quand cela n’est pas possible, il faut trouver un donneur non apparenté compatible, c’est-à-dire un individu dont les cellules ont une carte d’identité génétique la plus proche possible de celle du receveur.
Premier cas décrit de diabète après une greffe de sang de cordon
Revenons au cas du patient leucémique décrit par des hémato-oncologues de la faculté de médecine de l’université Teikyō (Itabashi, Tokyo). Sa leucémie a été diagnostiquée après la survenue récente d’une anémie. Trois mois avant la greffe de sang de cordon, son hémoglobine glyquée (HbA1c, témoin de la glycémie) est de 5,5 % (valeur normale < à 6,5 %). La glycémie à jeun est de 1g/L. On ne détecte pas la présence de glucose dans les urines. Il n’y a pas d’histoire familiale de diabète.
Le patient est en complète rémission après la chimiothérapie. L’hémoglobine glyquée (HbA1c) est alors de 4,8 % et le patient n’est plus anémique. Les hématologues procèdent ensuite à une allogreffe de cellules souches hématopoïétiques de sang de cordon à partir d’une donneuse non-apparentée.
Avant la transplantation de cellules souches hématopoïétiques pour cause de cancer, on administre au patient ce que l’on appelle « un protocole de conditionnement » (chimiothérapie et irradiation corporelle totale). Cette radiochimiothérapie intensive effectuée préalablement à la greffe vise à éliminer les cellules tumorales restantes ainsi que le système sanguin et immunitaire du patient, de sorte que le greffon puisse être accepté. Le conditionnement a ainsi pour objectif de prévenir la réaction du greffon contre l’hôte (GVH, graft versus host) au cours de laquelle la nouvelle moelle osseuse peut entraîner une réaction immunitaire ayant pour cible les antigènes de l’hôte, autrement dit produire des cellules qui attaquent les cellules du receveur. Le conditionnement vise donc à favoriser la prise de greffe.
Deux jours avant la greffe de sang de cordon, les médecins ont réalisé un bilan sanguin complet et ont alors recherché d’éventuels auto-anticorps pancréatiques (dont la présence permet de diagnostiquer un diabète). Les dosages des auto-anticorps recherchés – anticorps anti-acide glutamique décarboxylase (GAD) et anticorps antiprotéine tyrosine phosphatase (IA2) – sont négatifs. Le patient n’est d’ailleurs pas en hyperglycémie.
Cinq jours après la greffe, les médecins observent que leur patient présente une glycémie élevée (1,3 g/L). Celle-ci augmente pour atteindre un maximum de 4,32 g/L plus de 40 jours après la greffe.
Détection d’auto-anticorps anti-pancréatiques au 38e jour post-greffe
La présence de glucose dans le sang est détectée 16 jours après la greffe de sang de cordon. Le taux d’HbA1c est de 8,4 % au 38e jour post-greffe. Au même moment (J38), le dosage des auto-anticorps GAD est positif, alors que celui des auto-anticorps anti-IA-2 est négatif. Les dosages de peptide C (témoin de la production d’insuline par le pancréas) montrent que les taux diminuent. Le patient doit recevoir de l’insuline pour pallier l’insuffisance de sécrétion.
Sur la base de ces résultats (présence d’auto-anticorps anti-GAD et recours de l’insulinothérapie à un stade précoce), le patient est diagnostiqué comme diabétique de type 1.
C’est la première fois que l’on rapporte un cas de diabète de type 1 chez un patient ayant bénéficié d’une greffe de sang de cordon. À ce jour, les seuls cas de diabète rapportés après transplantation de cellules souches hématopoïétiques étaient survenus après allogreffe de moelle osseuse.
Une donneuse à haut risque de prédisposition au diabète
On sait que certaines caractéristiques du système HLA (qui code des protéines de reconnaissance du « soi » situées à la surface de nos cellules) confèrent une susceptibilité génétique au diabète de type 1 (DT1). Dans le cas de ce patient japonais, il s’avère que la donneuse de sang de cordon possède un gène (allèle) du système HLA associé à une forte prédisposition génétique au DT1. Elle est ainsi porteuse d’un allèle HLA de haut risque pour le DT1, alors que celui-ci était absent chez le receveur. Après la greffe de cellules souches hématopoïétiques, le patient n’était plus porteur de l’allèle 303 DQ présent avant la greffe, mais de l’allèle 0401.
Les médecins japonais font remarquer que leur patient a présenté une hyperglycémie très rapidement après la greffe, à peine cinq jours plus tard. Ils pensent que ce ne sont pas des lymphocytes dérivés des cellules souches hématopoïétiques qui sont à l’origine de la survenue d’un diabète chez ce patient. En revanche, on sait que le sang de cordon contient des lymphocytes du nouveau-né. Et les chercheurs de formuler l’hypothèse que dans ce cas, des lymphocytes, déjà présents dans le sang de cordon, seraient impliqués dans ce diabète de type 1 d’apparition récente.
Diabète après greffe allogénique de moelle osseuse
En 2013, une équipe polonaise a rapporté dans la revue Hormone Research in Paediatrics le cas d’une adolescente de 17 ans et demi, atteinte de leucémie aiguë lymphoblastique (LAL). Elle a développé un diabète après une radio-chimiothérapie à fortes doses suivie d’une greffe allogénique de cellules souches hématopoïétiques à partir d’un donneur apparenté. Le protocole de conditionnement comprenait une irradiation totale du corps entier et l’administration de ciclosporine comme prophylaxie de la réaction du greffon contre l’hôte (GVH). La patiente a cependant développé une GVH chronique, une pancréatite (J+128) et a présenté une infection par le virus des oreillons (J+154 post-greffe).
Cette jeune patiente atteinte de LAL avait reçu dans le cadre d’une chimiothérapie de la L-asparaginase. La L-asparaginase peut causer une forme réversible de diabète associé à une pancréatite. Quant à la ciclosporine, elle peut entraîner un diabète permanent, par destruction des îlots de cellules pancréatiques sécrétrices d’insuline.
Un an après la greffe, la patiente a présenté un diabète associé à certains composants d’un syndrome métabolique, tels qu’une résistance à l’insuline, une pression artérielle élevée et une dyslipidémie (augmentation du taux de lipides sanguins). Chez cette patiente sous traitement immunosuppresseur, il n’a pas été possible de doser les auto-anticorps associés au diabète.
Trois ans plus tard, la patiente a dû être traitée par des injections continues d’insuline administrée via une pompe. Cinq ans après la greffe allogénique de moelle osseuse, une détérioration du diabète a eu lieu, avec un taux d’HbA1c (hémoglobine glyquée) atteignant 9 %.
Afin de préciser la nature du diabète, les pédiatres et endocrinologues de l’université Jagellon de Cracovie ont dosé plusieurs auto-anticorps pancréatiques, tels que les GAD (anti-glutamate décarboxylase), IA2 (anti-tyrosines phosphatases), ICA (anti-cellules d’îlots) et IAA (anti-insuline). Tous étaient négatifs quatre ans et demi après le début du diabète. Le taux de peptide-C (témoin de la production d’insuline endogène) était dans les limites de la normale. Les médecins ont décidé d’ajouter de la metformine au traitement, ce qui a entraîné une nette amélioration du contrôle métabolique, avec diminution des besoins en insuline. Le taux d’HbA1c était alors de 8,2 %.
Dans le cas de cette jeune patiente polonaise, il apparaît donc que la survenue d’un diabète après greffe allogénique de cellules souches hématopoïétiques peut avoir une origine multifactorielle. Son diabète était probablement associé à la radiothérapie, mais également à certains médicaments tels que la L-asparaginase et la ciclosporine, sans oublier le rôle possible de la pancréatite et des oreillons.
En 2010, des médecins turcs ont rapporté dans la revue Endocrine Practice le cas de trois patients, atteints de leucémie, qui avaient présenté un diabète atypique d’apparition récente après greffe de moelle osseuse. Leur traitement immunosuppresseur comprenait des corticoïdes à fortes doses et du tacrolimus, médicaments qui ont pu contribuer à la survenue du diabète. Ces patients ont dû recevoir de petites quantités d’insuline pour contrôler la glycémie et finalement, tous ont connu une rémission complète du diabète, ce qui montre que la fonction des cellules bêta pancréatiques a été affectée de façon transitoire.
Les auteurs ont émis l’hypothèse que la greffe de moelle osseuse entraîne d’importants changements dans le profil immunitaire de l’hôte, avec augmentation de molécules inflammatoires (cytokines), qui peuvent altérer un temps la fonction des cellules bêta pancréatiques.
Au total, il apparaît que, selon le cas, le traitement de la réaction GVH par les corticoïdes et les immunosuppresseurs (en particulier ceux de la classe des inhibiteurs de la calcineurine, tels que le tacrolimus et la ciclosporine utilisés dans la prévention et le traitement de la maladie du greffon contre l’hôte), est associé à la survenue possible d’un diabète. L’irradiation corporelle totale durant le protocole de conditionnement est également un facteur de risque par altération de la fonction des cellules bêta pancréatiques, tout comme la maladie du greffon contre l’hôte qui génère des médiateurs inflammatoires et des cytokines capables d’endommager les tissus de l’hôte.
En résumé, la survenue d’un diabète après une greffe de cellules souches hématopoïétiques (CSH) doit être connue dans la mesure où il s’agit là d’un facteur important de morbidité chez ces patients. L’évaluation de la glycémie à jeun ou du taux de l’hémoglobine glyquée (après disparition de l’anémie) devrait faire partie du dépistage d’un éventuel diabète chez les survivants à long terme d’une greffe de CSH. Cela implique, de la part des endocrinologues et des médecins traitants, d’assurer un suivi à long terme pour ces patients.
Quid de la prévalence du diabète après greffe de CSH ?
En 2007, une étude américaine rétrospective publiée dans Blood a évalué la prévalence du diabète dans une cohorte de patients après transplantation de cellules souches hématopoïétiques (CSH). Il apparaît qu’après une greffe allogénique de CHS, les receveurs ont un risque 3,65 fois plus élevé de développer un diabète que les donneurs apparentés (servant de sujets contrôles). Publiée en 2010 dans Bone Marrow Transplantation, une étude canadienne rétrospective, avec un suivi médian de 8,6 ans, a montré que 7,6 % des receveurs d’une greffe allogénique de CSH avaient un diabète.
Il importe cependant de souligner que l’on dispose, pour évaluer au mieux la prévalence du diabète post-greffe de CSH, de peu de données prospectives et que l’on ne connaît pas toujours les facteurs de risque pré-transplantation pouvant contribuer à la survenue d’un diabète après transplantation. Par ailleurs, ces études portent sur des patients hétérogènes car souffrant de différents types de leucémies.
On le voit, il reste encore beaucoup à apprendre sur les mécanismes à l’origine de la survenue d’un diabète post-greffe de CSH et sur la réelle prévalence de cette complication.
Le transfert d’un diabète insulino-dépendant après greffe de moelle osseuse a été rapporté pour la première fois par des médecins allemands dans The Lancet en 1993. Il avait été transmis d’un frère, diagnostiqué diabétique huit ans plus tôt, à sa sœur de 29 ans qui souffrait d’anémie aplasique (maladie des cellules souches hématopoïétiques).
Marc GOZLAN (Suivez-moi sur Twitter, Facebook, LinkedIn, Mastodon)