Selon les résultats d’une méta-analyse et d’une revue systématique de la littérature médicale menée par une équipe australienne, une infection à entérovirus est fortement corrélée au développement d’un diabète de type 1. Il ressort que les personnes vivant avec un diabète de type 1 sont, par rapport à des sujets contrôles ayant une fonction pancréatique normale, huit fois plus susceptibles d’avoir présenté une infection à entérovirus [1].
On rappelle que le diabète de type 1 (DT1) est une maladie chronique métabolique qui résulte, chez des individus génétiquement prédisposés, de l’attaque par le système immunitaire des cellules bêta pancréatiques. On parle d’auto-immunité chez ces personnes qui développent des auto-anticorps dirigés contre ces cellules productrices d’insuline. La prédisposition génétique ne suffit cependant pas à expliquer l’augmentation rapide de l’incidence annuelle du DT1, de 3,9 % chez les enfants et adolescents au cours des dernières décennies.
Certains individus présentent une prédisposition génétique pour le DT1. La région génétique de plus forte susceptibilité correspond à celle des gènes HLA codant les antigènes HLA de classe II DR3 et DR4. Or ce génotype HLA, pourtant associé au risque génétique le plus élevé, ne rend compte au maximum que d’environ 40 % des cas de DT1. De plus, on observe un taux de concordance de 30 % à 70 % seulement chez les jumeaux monozygotes, au lieu de 100 %.
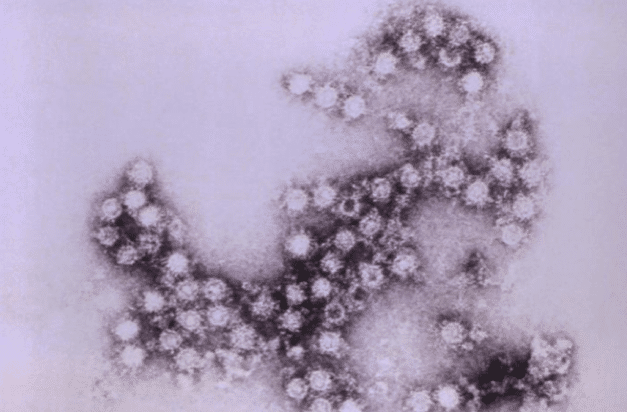
Tout ceci indique donc que des facteurs exogènes ou environnementaux (notamment des virus) sont impliqués dans le développement du diabète. Parmi les virus, on considère que les entérovirus peuvent déclencher ou accélérer l’auto-immunité dirigée contre les îlots pancréatiques. Petits virus, non enveloppés, d’une taille d’environ 30 nanomètres, les entérovirus sont composés d’une capside entourant un génome constitué d’une molécule d’ARN simple-brin.
Le genre Enterovirus comporte 15 espèces, dont 7 infectent l’homme. Il s’agit notamment des entérovirus A à D, qui regroupent plus de 110 sérotypes (caractéristiques antigéniques permettant de différencier des souches appartenant à une même espèce), dont les échovirus et les coxsackievirus de type B (CVB 1 à 6). Les entérovirus regroupent notamment de nombreuses souches de coxsackievirus, d’échovirus et de poliovirus. Les entérovirus sont excrétés dans les sécrétions respiratoires et les selles. Les divers mécanismes susceptibles de participer au déclenchement et à la progression de l’auto-immunité anti-îlots induite par les entérovirus, en particulier par les CVB, ne sont pas pleinement élucidés.
Des résultats épidémiologiques, cliniques et expérimentaux incriminent les entérovirus
Plusieurs études épidémiologiques et cliniques, auxquelles s’ajoutent des travaux expérimentaux, sont fortement en faveur de l’hypothèse selon laquelle les entérovirus sont fortement impliqués dans la pathogénèse du DT1. Des antigènes de la capside d’entérovirus ont été détectés sur des prélèvements post-mortem d’îlots pancréatiques de patients atteints de DT1, de même que dans des biopsies de pancréas de patients vivants et atteints d’un diabète de type 1. Des études sérologiques ont détecté la présence d’anticorps neutralisants dirigés contre des coxsackievirus B au même moment où l’on détectait l’apparition d’une auto-immunité dirigée contre les cellules bêta pancréatiques. En outre, des études menées auprès d’enfants génétiquement prédisposés au DT1 ont montré la présence de divers types d’entérovirus dans les selles avant le développement d’auto-anticorps dirigés contre les îlots pancréatiques. Il a enfin été récemment montré qu’une infection par ces virus peut persister dans le pancréas, la rate et le tissu lymphoïde de patients diabétiques de type 1 longtemps après le diagnostic. Tous ces résultats montrent que l’infection à entérovirus représente un important facteur environnemental possiblement impliqué dans le développement du DT1.
La méta-analyse australienne présentée au congrès EASD (European Association for the Study of Diabetes) renforce la corrélation entre infection à entérovirus et développement du DT1. Ainsi, il apparaît que les individus ayant développé des auto-anticorps anti-îlots sont deux fois plus susceptibles d’avoir présenté, à un moment quelconque, une infection à entérovirus [2].
Un risque de diabète 16 fois plus élevé en cas d’infection à entérovirus le mois précédent
Sonia Isaacs et ses collègues du département de pédiatrie et santé de l’enfant de l’université de la Nouvelle-Galles-du-Sud ont par ailleurs analysé un sous-groupe de 2 977 personnes chez lesquelles une infection à entérovirus avait été diagnostiquée au cours du mois précédent l’apparition du diabète. Il a été trouvé chez ces individus que le risque de développer un diabète d’apparition récente était 16,2 fois plus élevé [3].
Les individus qui ont développé une auto-immunité (anticorps anti-îlots) et finalement présenté cliniquement un DT1 étaient 5 fois plus susceptibles que les sujets contrôles d’avoir eu une infection à entérovirus.
Avoir eu plusieurs infections à entérovirus était associé à un risque deux fois plus élevé de développer des auto-anticorps dirigés contre les îlots pancréatiques.
Les familles d’entérovirus les plus souvent liés au risque de développer un diabète étaient les entérovirus A, B et C, et en particulier les coxsackievirus B1 et B4.
Communiquée à l’occasion du congrès annuel de l’EASD qui s’est tenu du 19 au 23 septembre 2022 à Stockholm (Suède), cette méta-analyse a porté sur les données moléculaires provenant de 12 077 patients (âgés de 0 à 87 ans). Elle a inclus 60 études observationnelles comportant un groupe de sujets sains contrôles (6 096 au total). Quarante études ont inclus 5 981 individus présentant un DT1. Neuf études portaient sur 900 sujets ayant développé une auto-immunité (anticorps anti-îlots). Enfin, 11 concernaient des patients présentant à la fois un diabète et une auto-immunité.
Les études publiées ont notamment utilisé le séquençage haut débit et les techniques analysant des cellules à l’échelle individuelle (single-cell technology) pour détecter une infection à entérovirus. Celle-ci a été identifiée, dans divers échantillons cliniques (sang, selles, tissu pancréatique, plus rarement biopsie intestinale ou salive), par la présence de l’ADN viral ou d’une protéine de la capside du virus.
Cette méta-analyse, qui renforce le rôle potentiel de l’infection à entérovirus dans le développement d’un DT1, est une mise à jour. Cette même équipe australienne avait déjà publié en 2011 dans le British Medical Journal (BMJ) une méta-analyse de 26 études sur le lien entre infection à entérovirus et pathogénèse du diabète de type 1. En une décennie, la détection moléculaire des virus a progressé, d’où la nécessité d’actualiser les données pour mieux cerner cette corrélation. Un lien de cause à effet ne peut cependant être formellement établi sur la base de résultats découlant d’études observationnelles.
Recherche de l’ARN d’entérovirus dans des prélèvements biopsiques de patients diabétiques vivants
Une étude norvégienne, publiée en août 2022 dans la revue Diabetologia, est également venue renforcer l’hypothèse qu’une infection à entérovirus des cellules des îlots pancréatiques soit impliquée dans le développement d’un diabète de type 1.
En 2015, l’équipe dirigée par Lars Krogvold et Knut Dahl-Jørgensen de l’université d’Oslo avait mené une étude sur 6 patients vivants récemment atteints de diabète de type 1. Baptisée DiViD (Diabetes Virus Detection), cette étude avait permis la détection par PCR du génome d’entérovirus (1 cas sur 6) et par immunohistochimie des protéines d’entérovirus dans du tissu pancréatique (dans les 6 cas). Utilisant cette fois des techniques innovantes hautement sensibles, cette équipe montre que le pancréas de chacun de ces 6 individus ayant récemment développé un diabète contient des entérovirus, à l’exception de tous les autres virus testés.
L’étude DiViD a porté sur six patients adultes, âgés de 24 à 35 ans, ayant récemment développé un diabète de type 1. Le diagnostic de diabète avait été établi trois à neuf semaines auparavant. Des biopsies pancréatiques, consistant à prélever un fragment de 2 à 3 cm de long de la queue du pancréas, ont été réalisées. Le groupe contrôle était composé de 11 individus (43-83 ans), ne souffrant pas de diabète, dont la biopsie pancréatique avait été effectuée à l’université de Pise (Italie) lors d’une intervention chirurgicale pour cancer du pancréas.
Pour détecter la présence d’entérovirus, les chercheurs ont utilisé plusieurs techniques : la croissance de virus sur cultures cellulaires, l’amplification par PCR des génomes correspondant à 20 virus différents et la détection de protéines de la capside virale d’entérovirus par un panel d’anticorps (immunofluorescence).
Le génome d’entérovirus détecté dans les six échantillons analysés
Il s’avère que le tissu pancréatique provenant de chacun des six sujets nouvellement diagnostiqués diabétiques renfermait du génome d’entérovirus. Il en était de même chez 2 des 11 individus contrôles ne présentant pas de diabète. La présence d’aucun autre virus n’a été trouvée dans les prélèvements biopsiques provenant des cas analysés.
La présence d’entérovirus a été confirmée par immunofluorescence sur des cellules en culture mises au contact d’extraits pancréatiques. Des antigènes du virus (dont la protéine entérovirale VP1 de la capside) ont été détectés dans le cytoplasme d’environ 1 % des cellules. Chez un patient, les cellules positives pour la protéine virale VP1 n’étaient pas seulement celles des îlots mais également d’autres cellules, dites ductales (qui produisent des enzymes se déversant dans le duodénum), ce qui montre que l’infection virale pourrait être plus diffuse dans certains cas.
En laboratoire, l’infection virale a pu être transmise à partir de cellules infectées à des cellules saines après avoir fait passer le milieu (surnageant) dans lequel baignent les cultures cellulaires contaminées à travers un filtre dont les pores ne laissent passer que des particules de moins de 100 nanomètres. Ceci indique que des agents infectieux d’une taille inférieure à 100 nanomètres sont présents dans les extraits pancréatiques (donc compatible avec le diamètre de 30 nanomètres des particules d’entérovirus), et qu’ils sont infectieux car capables de se répliquer dans des cellules infectées. Cependant, du fait de la croissance très lente des entérovirus dans les cultures cellulaires, des effets cytopathiques (altérations de la morphologie et/ou de fonction) n’ont pas été observés en microscopie standard, mais ont été détectés en évaluant la viabilité des cellules.
Des entérovirus viables dans le pancréas de patients avec un diabète récent
L’ensemble de ces résultats montre donc que les souches d’entérovirus détectées peuvent être transmises d’une cellule à une autre sous la forme de virus viables, se répliquant lentement lors d’une infection de bas niveau.
Selon les chercheurs norvégiens, ces résultats indiquent donc que « la phase précoce du diabète de type 1 est associée à une infection de bas grade par des entérovirus, mais non par d’autres agents viraux ». Selon eux, leur étude montre donc que « des génomes viraux et les protéines pour lesquelles ils codent peuvent être détectés à la fois dans le tissu pancréatique et dans des cellules en culture, et surtout, que des souches d’entérovirus obtenues à partir du pancréas sont vivantes et infectieuses. Ainsi, ces souches ne sont pas les vestiges d’acides nucléiques inertes ».
Le séquençage partiel de l’ARN viral a montré que les six cas étudiés sont associés à différentes espèces d’entérovirus (A, B, C), ce qui semble indiquer que plus d’un type d’entérovirus est associé au diabète.
Il importe néanmoins de souligner que les chercheurs ne sont pas parvenus à séquencer le génome d’entérovirus du fait des quantités extrêmement faibles d’acides nucléiques spécifiques de ces virus dans les prélèvements biopsiques, noyés dans l’abondance des acides nucléiques des cellules humaines. L’identification des entérovirus associés au DT1 dépendra donc du développement de méthodes de séquençage encore plus sensibles, devant permettre à l’avenir de reconstituer complètement des génomes viraux présents dans le tissu pancréatique de patients infectés ou ceux détectés dans des cultures cellulaires exposées au tissu pancréatique de ces mêmes patients.
En août 2021, une équipe conduite par des chercheurs allemands, britanniques et américains, a rapporté dans la revue Cell Reports Medicine, avoir détecté la présence d’ARN d’entérovirus dans le pancréas de donneurs d’organes, soit atteints de diabète de type 1, soit porteurs d’auto-anticorps associés au DT1 mais non diabétiques.
Les entérovirus ne ciblent pas exclusivement les cellules bêta sécrétrices d’insuline. Ils ont également été trouvés dans des cellules du pancréas exocrine, dont la fonction est de sécréter les enzymes digestives.
Shrin Geravandi, Kathrin Maedler et leurs collègues de l’université de Brême (Allemagne) ont également observé la présence de l’ARN d’entérovirus dans des cellules immunitaires pancréatiques chez les donneurs diabétiques de type 1 et ceux porteurs d’auto-anticorps associés au diabète. Enfin, l’ARN entéroviral a été détecté dans la rate (organe lymphoïde) de donneurs d’organes atteints de DT1, une observation en accord avec celle rapportée par d’autres équipes qui ont identifié de l’ARN d’entérovirus dans des globules blancs de patients au début de leur diabète ou plus tard. Les outils moléculaires utilisés n’ont pas permis d’identifier des séquences virales spécifiques de certains entérovirus.
Quid de la persistance d’une infection à coxsackievirus B ?
Reste à savoir si ces entérovirus associés au développement du diabète de type 1 jouent un rôle causal, autrement dit s’ils déclenchent l’apparition de la maladie. Comme toujours, corrélation ne signifie pas forcément causalité.
De prochaines études devront documenter l’excrétion d’entérovirus au moment du diagnostic de diabète (avec le risque possible d’infection chez les personnes apparentées au premier degré), évaluer le rôle des infections multiples à entérovirus dans la survenue du DT1, détecter ces virus au niveau intestinal et respiratoire avant et au moment du diagnostic du diabète, et déterminer s’il importe de systématiquement rechercher une infection à entérovirus lors du diagnostic de DT1.
Les entérovirus ne provoquent pas seulement des infections aiguës, ils peuvent aussi être responsables d’infections persistantes, comme cela a été observé dans des modèles animaux in vivo et des systèmes in vitro. Il a été ainsi montré que la persistance du coxsackievirus B (CVB) dans les cellules sécrétrices d’insuline et les cellules ductales du pancréas entraîne une inflammation chronique, du fait d’une participation active de l’immunité innée (première ligne de défense de l’organisme, avec activation de la réponse en interféron). Chez des individus génétiquement prédisposés, ce processus serait progressivement responsable du recrutement et de l’activation de cellules tueuses (lymphocytes T cytotoxiques) qui détruiraient les cellules bêta productrices d’insuline. La persistance de coxsackievirus B dans d’autres sites au sein de l’organisme, tels que l’intestin, des cellules sanguines et le thymus, pourraient servir de réservoirs pour une infection ou une réinfection du pancréas. Cette présence virale prolongée pourrait également être impliquée dans l’apparition d’une auto-immunité dirigée contre les îlots pancréatiques et la survenue d’un DT1.
Perspectives vaccinales et thérapeutiques
Une meilleure connaissance du rôle de la persistance d’une infection par entérovirus dans l’initiation et la progression vers le diabète de type 1 laisse entrevoir des perspectives à la fois en termes de prévention et de thérapeutique dans le DT1.
Il se pourrait que la preuve définitive du rôle causal des entérovirus dans le développement du DT1 soit finalement apportée par des essais cliniques évaluant l’efficacité de vaccins anti-entérovirus et de médicaments antiviraux. Ces approches vaccinales et thérapeutiques en sont aujourd’hui au stade expérimental ou à un stade précoce de développement.
« Des vaccins contre le CVB pourraient être efficaces en prévention primaire dans le DT1 s’ils sont administrés précocement à des enfants avant qu’ils ne soient exposés à ces virus », font remarquer Magloire Pandoua Nekoua, Didier Hober et leurs collègues du laboratoire de virologie de l’université de Lille dans une revue de la littérature sur l’infection persistante à coxsackievirus B et la pathogénèse du diabète de type 1, parue en janvier 2022 dans Nature Reviews Endocrinology.
Si des études devaient confirmer que plusieurs espèces ou types d’entérovirus sont associés au développement du DT1, cela pourrait signifier qu’un vaccin anti-entérovirus multivalent (et non monovalent) serait nécessaire pour réduire le risque de survenue d’un DT1. En 2020, un essai clinique randomisé de phase I a évalué chez des adultes l’immunogénicité et la sécurité d’emploi d’un vaccin hexavalent (dirigé contre les coxsackievirus 1 à 6). Ce même vaccin a par ailleurs montré une bonne tolérance et une forte capacité à induire la production d’anticorps neutralisants chez la souris et chez des singes macaques rhésus. Chez la souris, ce vaccin hexavalent s’est montré capable d’induire une immunité vis-à-vis d’une infection aiguë par le coxsackievirus B. Il a également bloqué l’apparition d’un diabète induit par le CVB dans un modèle de souris génétiquement prédisposées. Ces résultats, obtenus par des chercheurs suédois de l’Institut Karolinska (Stockholm), ont été publiés dans la revue en ligne Science Advances en mai 2020.
Autre piste prometteuse : le développement de médicaments antiviraux, administrables à un stade précoce de la maladie ou à des individus déjà exposés à des entérovirus et donc potentiellement porteurs d’une infection virale persistante. Selon les chercheurs lillois, « la mise au point d’un traitement antiviral capable d’éliminer l’infection persistante à entérovirus et pouvant être administré avant que l’apparition d’un DT1 clinique se manifeste, associé à des molécules inhibant les effets indésirables [sur le plan immunitaire] de l’infection à CVB, pourrait conduire à des traitements capables de combattre l’inflammation et de limiter le risque d’aggraver l’auto-immunité qui conduit au DT1 ».
Marc GOZLAN (Suivez-moi sur Twitter, Facebook, LinkedIn)
[1] Sur la base de 43 études, OR = 7,99 ; IC95%: 4,92-13,00, p < 0,00001).
[2] Sur la base de 16 études, OR = 2,07 ; IC95%: 1,30-3,31, p = 0,002).
[3] Sur la base de 25 études, OR = 16,2 ; IC95%: 8,6-30,5, p < 0,00001).